
| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多 | |
| B. | 已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,则有反应HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 已知氧气较臭氧稳定,则3O2(g)═2O3(g)△H>0 |
分析 A.硫蒸气具有的能量较高,燃烧时放出热量较大;
B.热化学方程式中,反应热与化学计量数成正比;
C.浓硫酸溶于水放热,则浓硫酸与氢氧化钠溶液反应放出的热量偏大;
D.物质具有的能量越低,其稳定性越强.
解答 解:A.等物质的量的硫蒸气和硫固体分别完全燃烧,硫蒸气具有的能量大于硫固体,则前者放出热量多,故A正确;
B.已知H2(g)+Cl2(g)═2HCl(g)△H=-184.6kJ•mol-1,根据焓变与化学计量数成正比可得:HCl(g)═$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H=+92.3kJ•mol-1,故B正确;
C.稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,由于浓硫酸溶于水放热,则将含0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合后放出热量偏大,即放出的热量大于57.3kJ,故C错误;
D.已知氧气较臭氧稳定,则氧气具有的能量较低,说明反应3O2(g)═2O3(g)为吸热反应,其△H>0,故D正确;
故选C.
点评 本题考查了反应热与焓变的应用,题目难度不大,明确热化学方程式的书写原则为解答关键,注意掌握物质稳定性与具有能量的关系,试题有利于提高学生的分析能力及灵活应用能力.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应是置换反应 | B. | 该反应中FeCl3作还原剂 | ||
| C. | 还原性:Fe>Cu | D. | 氧化性:CuCl2>FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
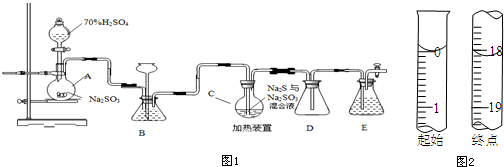
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )
),已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是( )| A. | 1molN4气体完全转变为N2将放出882kJ热量 | |
| B. | 14N2与15N2互为同位素,N4与N2互为同素异形体 | |
| C. | N4属于一种新型的化合物 | |
| D. | 14N与15N化学性质不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
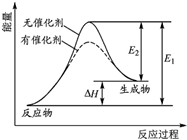 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 该反应为放热反应 | |
| B. | 催化剂能改变反应的焓变 | |
| C. | 催化剂能改变反应的路径,降低反应所需的活化能 | |
| D. | △H=E1+E2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变温度和使用催化剂都能改变化学反应速率 | |
| B. | 利用丁达尔效应可以区别FeCl3溶液和Fe(OH)3胶体 | |
| C. | 根据△G=△H-T△S推测:△H<0的化学反应都可以自发进行 | |
| D. | 将AlCl3溶液蒸干并灼烧,所得固体为Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粉身碎骨浑不怕,要留清白在人间 | B. | 曾青得铁则化为铜 | ||
| C. | 春蚕到死丝方尽,蜡炬成灰泪始干 | D. | 水滴石穿 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
,Q3Y2与水可剧烈反应,产生沉淀与气体,反应的化学方程式为Mg3N2+6H2O=3Mg(OH)2+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com