
a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物对应水化物呈碱性,且碱性b>a;c和d的气态氢化物的还原性d>c;五种元素的原子,得失电子后所形成的简单离子中e的离子半径最小,则它们的原子序数由小到大的顺序是( )
A.b、a、e、d、c B.e、b、a、d、c
C.c、d、e、a、b D.b、a、d、c、e
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
某同学在实验室中准备利用Na2S2O3溶液和稀H2SO4来验证浓度、温度对反应速率的影响。
【实验药品及仪器】:0.1 mol·L-1的Na2S2O3溶液、0.1 mol·L-1的稀H2SO4、、热水、冷水、蒸馏水、量筒、烧杯、试管(若干)、胶头滴管等。
【实验步骤】:
(1)写出反应的方程式
(2)验证浓度对反应速率的影响:
该同学想通过改变Na2S2O3的浓度来验证浓度对反应速率的影响。为了得到令人信服的实验结果,你认为他在实验中必须做到一致的几个因素是①
② ……(可不填满,也可补充)。
(3)验证温度对反应速率的影响:
该同学在两个烧杯中放入了等量的适量的热水和冷水,为了得到令人信服的实验结果,你认为他在实验中必须做到一致的几个因素是①
② ……(可不填满,也可补充)。
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是( )
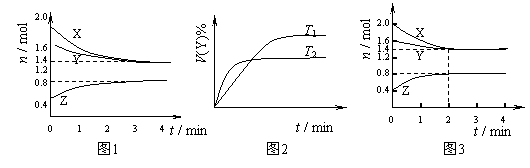
A.容器中发生的反应可表示为:3X(g)+Y(g) 
 2Z(g)
2Z(g)
B.保持其他条件不变,升高温度,化学平衡向逆反应方向移动
C.反应进行前4 min内,用X表示的反应速率 v(X)=0.075mol•(L•min) -1
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.SiO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与 CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C 三种元素的原子具有相同的电子层数;B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多5;1molA的单质跟盐酸反应可置换出11.2L(标准状况下)氢气,这时A转变成与氖原子具有相同电子层结构的离子。试回答:
(1)写出下列元素名称:A__________,C__________。
(2)写出A、B最高价氧化物对应水化物分别与C的气态氢化物水溶液反应的离子方程式
、 。
(3)已知金属元素D和元素A、B在同一周期。分别向B,D最高价氧化物对应水化物中滴人A的最高价氧化物对应水化物的溶液,观察到的现象为
发生反应的化学方程式为__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入32.5 mL 4.00 mol•L-1 NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀2.03 g。再将滤液稀释至100mL,测得滤液中c(OH-)=0.2 mol•L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35 g。关于原溶液组成结论正确的是
A.一定含有Mg2+、Al3+、Cl-,不含有Na+、NH4+
B.一定含有Na+、Mg2+、Cl-,不含有NH4+、可能含有Al3+
C.c(Mg2+)为1.75 mol•L-1,c(Na+)为1.50 mol•L-1
D.c(Cl-)为5.00 mol•L-1,c(Al3+)为1.00 mol•L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 甲 | CO2 | HCl | CO2 | NO2 | CO2 |
| 乙 | SO2 | CO2 | SO2 | SO2 | NH3 |
| 丙 | 石灰水 | 石灰水 | Ba(NO3)2 | BaCl2 | CaCl2 |
|
| A. | ①②③④⑤ | B. | ②③④⑤ | C. | ①③④ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com