
【题目】25℃时,Ka(CH3COOH)=1.8×10-5、Ka(HClO)=3.0×10-8、Ksp(AgCl)=4.0×10-10、Ksp(AgBr)=5.0×10-13。下列说法正确的是
A. 由电离常数分析,CH3COOH溶液的pH一定比HClO溶液的pH小
B. 物质的量浓度相等的CH3COONa和NaClO混合溶液中,各离子浓度大小关系为:
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH)>c(H+)
C. 25℃时,反应AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K=800
AgBr(s)+Cl-(aq)的平衡常数K=800
D. 物质的量浓度相等的NaClO溶液和CH3COONa溶液相比较,两者离子的总浓度相等
【答案】C
【解析】A. 溶液的pH不仅与酸的强弱有关,还与浓度有关,故A错误;B. 物质的量浓度相等的CH3COONa和NaClO混合溶液中醋酸钠的水解程度小于次氯酸钠,各离子浓度大小关系为:c(Na+)>c(CH3COO-)>c(ClO-)>c(OH)>c(H+),故B错误;C. 25℃时,反应 AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K=
AgBr(s)+Cl-(aq)的平衡常数K= =
= =800,故C正确;D. NaClO溶液水解程度大,溶液中存在c(Na+)+c(H+)=c(OH-)+c(ClO-),CH3COONa溶液水解程度小,溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于次氯酸钠溶液中c(H+)小于醋酸钠溶液中的c(H+),因此离子的总浓度小,故D错误;故选C。
=800,故C正确;D. NaClO溶液水解程度大,溶液中存在c(Na+)+c(H+)=c(OH-)+c(ClO-),CH3COONa溶液水解程度小,溶液中存在c(Na+)+c(H+)=c(OH-)+c(CH3COO-),由于次氯酸钠溶液中c(H+)小于醋酸钠溶液中的c(H+),因此离子的总浓度小,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A.XYZ2 B.X2YZ3 C.X2YZ2 D.XYZ3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应热的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ba(OH)2反应生成1molH2O时会放出57.3kJ的热量
B. 由C(石墨,s)——C(金刚石,s)△H=+1.9 kJmol-1可知,石墨比金刚石更稳定
C. 在500℃、MPa下,将0.5 mol N2和l.5 mol H2置于密闭容器中充分反应生成NH3,放热19.3kJ,则其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJmol-1
2NH3(g) △H=-38.6 kJmol-1
D. 甲烷的燃烧热(△H)为-890.3 kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) △H=-890.3 kJmol-1
CO2(g)+2H2O(g) △H=-890.3 kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为原子序数递增的四种短周期元素,其中Y、Z为金属元素。X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如图所示反应关系(关系图中“—”相连的两种物质能发生反应)。下列判断正确的是

A. X是元素周期表中非金属性最强的元素 B. Z位于元素周期表第3周期IA族
C. 四种原子中,Y原子半径最小 D. W的简单阴离子可能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关卤族元素与0族元素的说法正确的是
A. 卤族元素易与第ⅠA族元素形成盐
B. 0族元素可统称为稀有气体元素
C. XeF6中Xe的化合价为0,因为Xe是0族元素
D. 砹(At)是第ⅦA元素,其固体单质的分子式为At
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在生活中有广泛应用,根据所需知识回答下列问题。
(1)氟元素基态原子的价电子排布图:_________,卤族元素位于元素周期表______区。
(2)在一定浓度的氢氟酸溶液中,部分溶质以二分子缔合(HF)2形式存在,使HF分子缔合的作用力是_______________。
(3)BF3常温下是气体,有强烈的接受弧电子对的倾向。BF3分子的立体构型为______,固态时的晶体类型是_______,BF3与NH3相遇立即生成白色固体,写出该白色固体物质的结构式并标注出其中的配位键_____。
(4)根据下表提供的数据判断,熔点最高、硬度最大的是_______(填化学式)。
离子晶体 | NaF | MgF2 | AlF3 |
晶格能(KJ·mol-1) | 923 | 2957 | 5492 |
(5)已知NaClO2晶体中阴离子为V型,ClO2-中氯原子的弧电子对数是______,ClO2-中氯原子的杂化轨道类型为_____,HClO4比HClO2酸性强的原因是_______。
(6)CaF2晶胞如下图所示。已知:NA为阿伏伽德罗常数,棱上相邻的两个Ca2+的核间距为acm,则CaF2的密度可表示为_____g·cm-3。
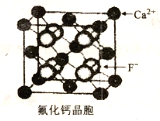
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:

(1)甲池中通入CH4电极的电极反应为___________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”、“负极”或“阴极”、“阳极”), 乙池中总反应式为____________________________________ 。
(3)当乙池中B极质量增加5.40g时,甲池中理论上消耗O2的体积为______mL(标准状况),丙池中______(填“C”或“D”)极析出_______g铜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿(主要成分为MgCO3、含少量FeCO3、SiO2)制备高纯氧化镁的流程如下图所示:

己知:25℃时,指示剂变色pH范围和几种氢氧化物的ksp及pH的关系如下表:
指示剂 | 酚酞 | 甲基酸 |
变色范围(pH) | 8.2-10.0 | 3.1-4.4 |
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀时pH | 1.1 | 5.9 | 8.4 |
沉淀完全时pH | 3.7 | 9.6 | 10.2 |
溶度积常数 | 4×10-34 | 8×10-16 | 2×10-13 |
(1)操作II和III中涉及的分离方法分别是____________、_______________。
(2)残渣I的主要成分是____________,加入H2O2的过程中可观察到的现象是___________,其中发生的离子反应方程式是_________________________。
(3)MgSO4和木炭在800℃煅烧时,只生成MgO和两种气体,将混合气体通入NaOH溶液时,气体被完全吸收。煅烧时发生反应的化学方程式是_____________。
(4)采用滴定法测定溶液II与加入氨水的最佳体积比,可以减少氨水的消粍和Mg2+的损失。实验中应选取_______________指示剂,加入氨水是为了沉淀溶液II中的___________离子,若终点时该离子浓度=1.0×10-5mol·L-1,则溶液III的pH=_____________(己知:lg2=0.3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L 的NaOH溶液,溶液中水所电离出的c(H+)随加入NaOH溶液的体积变化示意图如下,下列说法正确的是

A. 从a到c,对醋酸的电离既有促进作用也有抑制作用
B. b、d两点溶液的pH相同
C. e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) = 0.01mol/L
D. 从b→d的过程中,既存在pH=7的点也存在水电离的c(H+)=10-7的点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com