
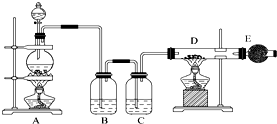
 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D. 分析 (1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,依据氯化氢和浓硫酸的性质选择除杂试剂;
(3)氯气与铁在加热条件下生成氯化铁;
(4)氯气有毒,能够与氢氧化钠,可以用碱石灰进行尾气处理;碱石灰具有吸水性,能够防止空气中的水蒸气进入D.
解答 解:(1)二氧化锰与浓盐酸在加热条件下生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,浓硫酸具有吸水性,能够干燥氯气;
故答案为:饱和食盐水;除去氯气中的氯化氢;浓硫酸;干燥氯气;
(3)氯气与铁在加热条件下生成氯化铁,方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,故答案为:Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)氯气有毒,能够与氢氧化钠,可以用碱石灰进行尾气处理;碱石灰具有吸水性,能够防止空气中的水蒸气进入D,
故答案为:吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
点评 本题考查了氯气的制备和性质的检验,熟悉制备原理及各装置的作用是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol Na被氧化完全转化生成Na2O2,失去电子数为2NA | |
| B. | 常温常压下,46g由NO2和N2O4组成的混合气体中含有原子的总数为3NA | |
| C. | 将lmL 1 mol•L-1FeCl3溶液逐滴加入沸水,制得红褐色Fe(OH)3胶体,所含胶粒的数目是1×10-3NA | |
| D. | 标准状况下,6.72L NO2与足量水充分反应转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 mol/L | B. | 1.5 mol/L | C. | 1.0 mol/L | D. | 0.5 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶事先未烘干 | B. | 定容时观察液面仰视 | ||
| C. | 定容时观察液面俯视 | D. | 定容,摇匀后有少量液体流出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2BrCH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 硬酯酸甘油脂  | D. | 2,2-二甲基-3-丁醇 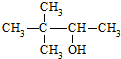 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24 L己烷中,分子数为0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl键数为NA | |
| C. | 常温常压下16 g O2和O3混合气体中,氧原子数为NA | |
| D. | 7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com