
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的NH4+,模拟装置如下图所示。下列说法不正确的是

A. 阳极室溶液由无色变成浅绿色
B. 当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成
C. 电解时中间室(NH4)2SO4溶液浓度下降
D. 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
【答案】D
【解析】A.根据装置图知,Fe为阳极,阳极上Fe 失电子发生氧化反应生成亚铁离子,所以溶液由无色变成浅绿色,A正确;B.阴极上H+放电生成H2,电极反应式为2H2O+4e-=2OH-+H2↑,因此当电路中通过lmol电子的电量时,阴极有0.5mol的气体生成,B正确;C.电解时,溶液中NH4+向阴极室移动,中间室(NH4)2SO4溶液浓度下降,C正确;D.电解时,溶液中NH4+向阴极室移动,H+放电生成H2,溶液中OH-和NH4+结合生成电解质NH3·H2O,所以阴极室中溶质为NH3·H2O和(NH4)3PO4或NH4HPO4、(NH4)2HPO4,D错误;答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A. 自然界硅的贮量丰富
B. 自然界中存在大量单质硅
C. 二氧化硅被用于制作计算机芯片
D. 光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室制取少量乙酸乙酯的装置图。下列关于该实验的叙述中,不正确的是
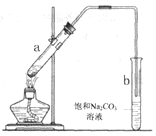
A. 试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
B. 实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
C. 试管b中饱和![]() 溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇
D. 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z是短周期元素,原子半径的大小:r(Y)>r(X)>r(Z),三种元素的原子序数之和为15;X、Y、Z三种元素的常见单质在适当条件下可发生如下图所示转化关系,其中R为10电子分子,是一种常见的无机溶剂。下列说法不正确的是

A. X元素位于周期表中的第16列
B. X的氢化物沸点一定高于Y的氢化物的沸点
C. X、Y、Z元素可以组成一种分子式为Z2Y2X4的化合物,其水溶液中水的电离受到了抑制
D. X、Y、Z元素两两之间均能形成原子个数比为1 : 1的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017江苏]铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然橡胶和香料柑青酸甲酯衍生物F的合成路线如下:

已知:①RCHO+R′CH2CH=CH2![]()
![]()
② (R、R′可以是氢原子、烃基或官能团)
(R、R′可以是氢原子、烃基或官能团)
(1)F在一定条件下能发生________、________、________等反应(任写3个)
(2)试剂a的名称是________;
(3)关于试剂b的下列说法不正确是________(填字母序号).
a.存在顺反异构体b.难溶于水
c.能发生取代、加成和氧化反应d.不能与NaOH溶液发生反应
(4)C发生反应生成D的反应类型是________;
(5)B与试剂E反应生成F的化学方程式是______________________________________________;
(6)C的结构简式是______________________________;
(7)分子中含有![]() 和
和![]() 结构的D的所有同分异构共有________种(不包括顺反异构体),写出其中任意两种的结构简式___________________________、_________________________。
结构的D的所有同分异构共有________种(不包括顺反异构体),写出其中任意两种的结构简式___________________________、_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、铝都为重要的短周期元素,其单质及化合物在工农业生产生活中有着重要作用。请回答下列问题:
(1)在密闭容器内(反应过程保持体积不变),使1 mol N2和3 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=92.4 kJ·mol1。当反应达到平衡时,N2和H2的浓度之比是__________;当升高平衡体系的温度,则混合气体的平均式量________(填“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1 mol N2,H2的转化率__________(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡__________移动(填“正向”“逆向”或“不”)。
2NH3(g) ΔH=92.4 kJ·mol1。当反应达到平衡时,N2和H2的浓度之比是__________;当升高平衡体系的温度,则混合气体的平均式量________(填“增大”“减小”或“不变”);当达到平衡时,再向容器内充入1 mol N2,H2的转化率__________(填“提高”“降低”或“不变”);当达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡__________移动(填“正向”“逆向”或“不”)。
(2)由题干所述元素中的三种组成的某种强酸弱碱盐的化学式为__________,其溶于水能________水的电离(填“促进”或“抑制”),且使溶液的pH________(填“升高”“降低”或“不变”),原因是____________________________(用离子方程式表示)。
(3)空气是硝酸工业生产的重要原料,氨催化氧化是硝酸工业的基础,氨气在铁触媒作用下只发生主反应①和副反应②:
4NH3(g)+5O2![]() 4NO(g)+6H2O(g) ΔH=905 kJ·mol1 ①
4NO(g)+6H2O(g) ΔH=905 kJ·mol1 ①
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=1268 kJ·mol1 ②
2N2(g)+6H2O(g) ΔH=1268 kJ·mol1 ②
①氮气与氧气反应生成NO的热化学方程式为__________________________。
②在氧化炉中催化氧化时,有关物质的产率与温度的关系如图。下列说法中正确的是____________。

A.工业上氨催化氧化生成NO时,最佳温度应控制在780~840 ℃之间
B.工业上采用物料比![]() 在1.7~2.0,主要是为了提高反应速率
在1.7~2.0,主要是为了提高反应速率
C.加压可提高NH3生成NO的转化率
D.由图可知,温度高于900 ℃时,生成N2的副反应增多,故NO产率降低
(4)M是重要的有机化工原料,其分子与H2O2含有相同的电子数,将1 mol M在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则M的化学式为__________。某种燃料电池采用铂作为电极催化剂,以KOH溶液为电解质,以M为燃料,以空气为氧化剂。若该电池工作时消耗1 mol M,则电路中通过__________mol电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com