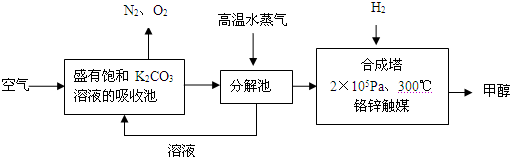
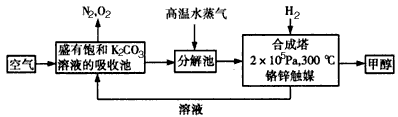
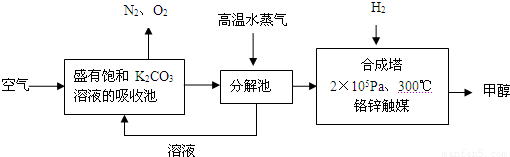
解:(1)依据流程图分析判断,分解池中发生的反应为碳酸氢钾分解生成碳酸钾、二氧化碳和水,反应的化学方程式为:2KHCO
3
K
2CO
3+CO
2↑+H
2O,
故答案为:2KHCO
3
K
2CO
3+CO
2↑+H
2O;
(2)根据CO
2与足量H
2恰好完全反应生成32g甲醇和水,可放出49.5 kJ的热量,则生成1 mol CH
3OH放出热量49.5 kJ的热量,所以热化学方程式为
CO
2(g)+3H
2(g)=CH
3OH (g)+H
2O(g)△H=-49.5kJ?mol
-1,故答案为:CO
2(g)+3H
2(g)=CH
3OH (g)+H
2O(g)△H=-49.5kJ?mol
-1;
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,较低温时反应速率过慢,生产效率低,合成塔中维持300℃的较高温度的原因提高反应速率,催化剂在此温度下活性最大,反应是放热反应,气体体积减小的反应,依据平衡移动原理可知反应正向进行提高甲醇的产率,
故答案为:该温度下催化剂的活性最高;降温;加压或将水和甲醇从混合体系中分离出来;
(4)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,碱性电解质溶液中电极反应为:CH
3OH+8OH
--6e
-=CO
32-+6H
2O或:2CH
3OH+16OH
--12e
-=2CO
32-+12H
2O,
故答案为:CH
3OH+8OH
--6e
-=CO
32-+6H
2O或:2CH
3OH+16OH
--12e
-=2CO
32-+12H
2O;
(5)常温常压下,饱和CO
2水溶液的pH=5.6,c(H
+)=c(HCO
3-)=10
-5.6mol/L;c (H
2CO
3)=1.5×10
-5mol?L
-1,若忽略水的电离和H
2CO
3的二级电离,则H
2CO
3?HCO
3-+H
+的平衡常数K=
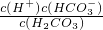
=
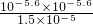
=
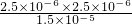
=4.2×10
-7mol?L
-1,故答案为:4.2×10
-7 mol?L
-1;
(6)根据CaCO
3、BaCO
3的溶度积大小可知BaCO
3更难溶,因此令CO
2生成BaCO
3反应更完全,故可选择Ba(OH)
2(或NaOH溶液和BaCl
2溶液)作为CO
2的沉淀剂,测定的数据除空气的体积外,还需要测定实验时的温度、压强、沉淀的质量,故答案为:Ba(OH)
2(或NaOH溶液和BaCl
2溶液),故答案为:AD.
分析:(1)二氧化碳通入饱和碳酸钾溶液的吸收池中反应生成碳酸氢钾,高温水蒸气条件下分解生成碳酸钾、二氧化碳和水;
(2)依据热化学方程式书写方法,计算对应量下的反应热,书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位;写出热化学方程式;
(3)依据反应速率和催化剂的活性分析判断;根据平衡影响因素和平衡移动原理分析选择;
(4)燃料电池是燃料在负极失去电子发生氧化反应,氧气在正极得到电子发生还原反应;依据氧化还原反应电子守恒和电荷守恒,注意电解质溶液的环境因素写出电极反应;
(5)根据饱和溶液中PH计算氢离子浓度和碳酸氢根离子浓度,依据电解质电离平衡常数的概念计算;
(6)根据CaCO
3、BaCO
3的溶度积大小可知BaCO
3更难溶,因此令CO
2生成BaCO
3反应更完全.
点评:本题以对CO
2创新利用的研究为载体,考查热化学方程式、沉淀剂选择等知识,难度中等,旨在考查学生对知识的掌握及迁移运用能力.

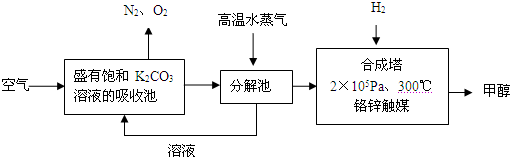
 K2CO3+CO2↑+H2O,
K2CO3+CO2↑+H2O, K2CO3+CO2↑+H2O;
K2CO3+CO2↑+H2O;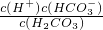 =
=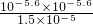 =
=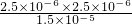 =4.2×10-7mol?L-1,故答案为:4.2×10-7 mol?L-1;
=4.2×10-7mol?L-1,故答案为:4.2×10-7 mol?L-1;