
| A. | 次氯酸是一种弱酸是因为次氯酸不稳定,易分解 | |
| B. | 用氯气制漂白粉的主要目的是转变为较稳定,便于贮存的物质 | |
| C. | 漂白粉在空气中容易失效的原因是次氯酸钙易和空气中的水及二氧化碳反应 | |
| D. | 氯原子最外层有7个电子,故在化学反应中易结合一个电子而形成Cl- |
分析 A.次氯酸的酸性与电离出氢离子的难易程度有关,与稳定性无关;
B.氯气是气体,不便保存和运输,将气体转化为较稳定固体物质便于保存和运输;
C.Ca(ClO)2易与空气中的CO2和H2O反应生成次氯酸,次氯酸不稳定,易分解;
D.卤素原子最外层电子数均是7,易得到电子.
解答 解:A.次氯酸的酸性与电离出氢离子的难易程度有关,与稳定性无关,如HI为强酸,但不稳定,要证明次氯酸为弱酸,应从电解质是否完全电离,是否存在电离平衡以及对应的盐溶液的酸碱性等角度思考,故A错误;
B.氯气是气体,不便保存和运输,将气体转化为较稳定固体物质便于保存和运输,所以工业上将氯气制成漂白粉,故B正确;
C.漂白粉的有效成分为Ca(ClO)2,由于HClO的酸性比碳酸弱,Ca(ClO)2易与空气中的CO2和H2O反应生成次氯酸,次氯酸不稳定,易分解,故C正确;
D.氯原子最外层有7个电子,在化学反应中容易得到一个电子形成稳定的氯离子,故D正确.
故选A.
点评 本题考查氯及其化合物的性质,为高频考点,侧重于化学与生活、生产的考查,注意把握判断酸性强弱的角度和物质的性质,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;BA4的结构式
;BA4的结构式 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
| A. | 0~20 s内,v(NO2)=0.005 mol•L-1•s-1 | |
| B. | 59 s时,c(NO2)一定大于0.12 mol•L-1 | |
| C. | 若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K>$\frac{25}{9}$ | |
| D. | 若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-离子的结构示意图: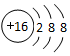 | B. | 硫酸铝的化学式:AlSO4 | ||
| C. | H2O2中O的化合价为-2价 | D. | 钾原子的原子结构示意图: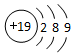 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 5 | 10 | 20 | 30 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
| A. | 反应在前5 s的平均速率v(A)=0.03 mol•L-1•s-1 | |
| B. | 达到平衡时,B的转化率为80% | |
| C. | 相同温度下,若起始时向容器中充入2.0 mol C,则达到平衡时C的浓度小于0.2 mol•L-1 | |
| D. | 相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌 | |
| D. | 实验室中酒精燃烧,小面积着火,立即用水扑灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
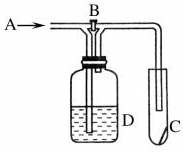 如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关.若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B在A处通入干燥的氯气时,C中红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓NaI溶液 | B. | 浓NaOH溶液 | C. | 饱和NaCl溶液 | D. | 浓硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com