
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
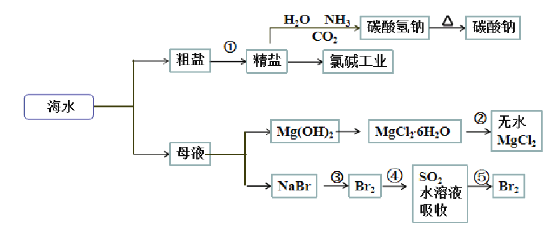
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
下列有关说法正确的是
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上将石灰水加入到海水中得到Mg(OH)2沉淀
【答案】A
【解析】
A、反应为NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl;
B、镁离子会水解;
C、在第③、⑤步骤中发生的反应为2NaBr+Cl2=2NaCl+Br2,在第④步骤中发生的反应为Br2+SO2+2H2O=H2SO4+2HBr;
D、氢氧化钙溶解度小;
A、反应为NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl,制取NaHCO3的反应是利用其溶解度小于NaCl,故A正确;
B、氯化镁易水解,为防止氯化镁水解,由MgCl2·6H2O在HCl气体的环境下,加热制取无水MgCl2,Mg是活泼金属,工业上采用电解熔融氯化镁的方法冶炼镁,故B错误;
C、在第③、⑤步骤中发生的反应为2NaBr+Cl2=2NaCl+Br2,在第④步骤中发生的反应为Br2+SO2+2H2O=H2SO4+2HBr,所以在第③、⑤步骤中,溴元素均被氧化,在第④步骤的溴做氧化剂,故C错误;
D、氢氧化钙溶解度小,工业上将石灰乳加入到沉淀池中,经过滤得到Mg(OH)2沉淀,故D错误;
故选A。


科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的氧化物既是可导致酸雨的物质,也是造成空气污染的重要物质,加大对氮的氧化物的治理是环境保护重要举措。
(1)在一定条件下氨气可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式: _____________________________,该反应中氧化剂是_________,还原剂是________________________________________。
(2)汽车尾气中含有CO和NO,消除这两种物质对大气的污染的方法是安装催化转化器,使它们发生反应生成对大气无污染的气体,该反应的化学方程式为___________________________________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH===2NaNO2+H2O
2NO2+2NaOH===NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收nmol NO2和mmol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为_________ mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=_________。
③用含n和m的代数式表示所得溶液中NO3-和NO2-浓度的比值c(NO3-)∶c(NO2-)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个恒容的密闭容器中进行下列两个可逆反应:
甲:C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
乙:CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
现有下列状态:①混合气体平均相对分子质量不再改变
②恒温时,气体压强不再改变 ③各气体组成浓度相等
④反应体系中温度保持不变 ⑤断裂氢氧键速率是断裂氢氢键速率的2倍 ⑥混合气体密度不变 ⑦单位时间内,消耗水蒸气质量与生成氢气质量比为9∶1
其中能表明甲、乙容器中反应都达到平衡状态的是( )
A. ①②⑤ B. ③④⑥ C. ⑥⑦ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一处于平衡状态的可逆反应:X(s)+3Y(g)![]() 2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是
①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z
A.①③⑤B.②③⑤C.②③⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍(Ni)有良好的耐高温、耐腐蚀、防锈功能,在电池、催化剂方面有广泛的应用。以硫化镍矿(主要成分为NiS,另含少量CuS,FeS等杂质)为原料制取纯镍的工艺流程如下:
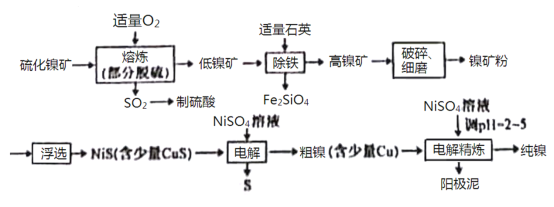
已知物质的还原性:Fe>Ni>H2>Cu。
回答下列问题:
(1)在“熔炼”过程中,二价铁的化合价没有发生改变,则杂质FeS与O2反应的化学方程式为___________________。
(2)高镍矿破碎、细磨的作用是___________________。
(3)在焰色反应实验中,可以用光洁无锈的镍丝代替铂丝蘸取化学试剂灼烧,原因是___________________。
(4)“除铁”过程中,反应的化学反应方程式为___________________。
(5)“电解”制粗镍过程中,阳极发生的主要电极反应为___________________。
(6)“电解精炼”过程中,需调节溶液的pH为2~5,原因是___________________。阳极泥的成分为___________________(写名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A.达到化学平衡时,4v正(O2) = 5v逆(NO)
B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞德西韦是一种核苷类似物,具有抗病毒活性,对新型冠状病毒病例展现出较好的疗效。其结构如图所示:

回答下列问题:
(1)该结构基态P原子中,核外电子占据最高能层的符号是________________,占据该能层电子的电子云轮廓图形状为________________。
(2)瑞德西韦中位于第二周期元素的第一电离能从大到小的顺序为________________,分子中氮原子的杂化类型有________________。
(3)苯酚(![]() )是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(
)是合成瑞德西韦的原料之一,其熔点为43℃,苯酚的晶体类型是________________。苯酚与甲苯(![]() )的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
)的相对分子质量相近,但苯酚的熔、沸点高于甲苯,原因是________________。
(4)MgSO4是合成瑞德西韦的催化剂之一。MgSO4中,阴离子的空间构型为________________。
(5)磷酸也是合成瑞德西韦的原料之一。直链的多磷酸盐则是-种复杂磷酸盐,如:焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
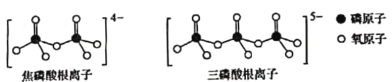
这类磷酸根离子的化学式可用通式表示为________________(用n代表P原子数)。
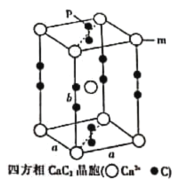
(6)合成瑞德西韦的原料之一的苯酚可通过如下途径制得:电石(CaC2)→乙烯→苯→溴苯→苯酚。四方相碳化钙(CaC2)晶体的晶跑结构如图所示.其晶胞参数分别为apm、apm、bpm,四方相碳化钙晶体的密度为![]() g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
g·cm-3,[C≡C]2-中键长为cpm,阿伏加德罗常数的值为NA.则m位置的钙离子与P位置的碳原子之间的距离为________________pm(用不含a的计算表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅又称硅石,是制备硅及含硅化合物的重要原料。部分转化过程如图所示,下列说法正确的是
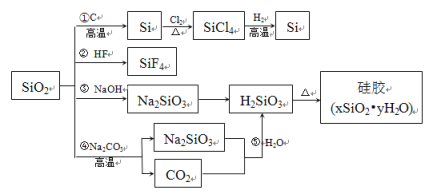
A.SiO2既能发生②反应,又能发生③反应,说明SiO2属于两性氧化物
B.④反应是水泥工业的化学反应原理之一,⑤反应可证明H2CO3酸性强于H2SiO3
C.①反应的生成物除Si外还有CO2,硅胶可用作催化剂的载体
D.除了粗硅的制备和提纯过程中涉及的反应外,图中所示其他反应都是非氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com