
| A. | 钠的金属活泼性大于铜,在溶液中钠可以置换出铜 | |
| B. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入KNO3固体,铜粉仍不溶解 | |
| C. | 在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成 | |
| D. | 纯锌与稀硫酸反应产生氢气的速率较,加入少量CuSO4固体,速率不改变 |
分析 A、根据钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应;
B、根据铜的化学性质,如:铜不能与非氧化性酸反应,但可以和氧化性酸反应,酸性条件下硝酸盐反应;
C、碘离子具有还原性,加入硝酸钠不反应,加入盐酸形成稀硝酸具有氧化性,氧化碘离子为单质碘;
D、锌和铜在酸性条件下形成原电池反应,反应速率较大.
解答 解:A、钠与盐溶液反应时,先与水反应,然后生成的碱再与盐反应,所以Na不能从铜盐溶液中置换出Cu,故A错误;
B、根据铜与稀HNO3反应,由该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,故B错误;
C、碘离子具有还原性,加入硝酸钠不反应,加入盐酸形成稀硝酸具有氧化性,在KI溶液中加入NaNO3,没有明显现象,加入盐酸,即有I2生成,故C正确;
D、加入少量CuSO4固体,置换出铜,锌和铜在酸性条件下形成原电池反应,反应速率较大,故D错误;
故选C.
点评 本题考查了物质性质的分析判断,主要是氧化还原反应发生的条件和产物判断,掌握基础是关键,题目较简单.


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
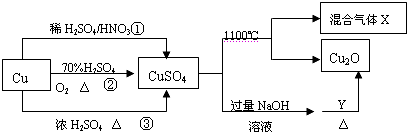
| A. | 1mol CuSO4在1100℃所得混合气体X中O2可能为0.75mol(X的组成为SO2、SO3、O2) | |
| B. | 相对于途径①、②,途径③更好地体现了绿色化学理念 | |
| C. | 途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 | |
| D. | Y一定是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
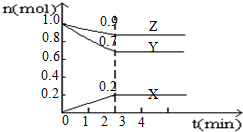 某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在4L的容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | J | |||||||
| 2 | E | K | F | |||||
| 3 | A | C | D | I | G | R | ||
| 4 | B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2<$\frac{{Q}_{1}}{2}$ | B. | Q2>$\frac{{Q}_{1}}{2}$ | C. | Q2=$\frac{{Q}_{1}}{2}$ | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
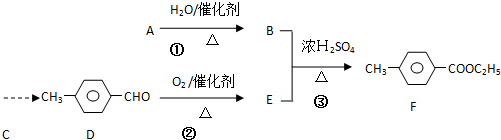
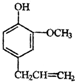 )是一种重要的调味剂,它与F的关系是b(填序号).
)是一种重要的调味剂,它与F的关系是b(填序号).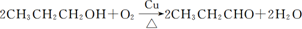 ,氧化反应;
,氧化反应;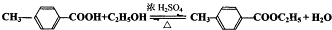 ,取代反应(或酯化反应).
,取代反应(或酯化反应).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物与还原产物粒子个数比是2:5 | |
| B. | 被氧化的盐酸占参加反应盐酸总数的$\frac{5}{8}$ | |
| C. | KMnO4只有一部分发生还原反应 | |
| D. | KMnO4与HCl恰好分别完全发生还原反应和氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com