


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

 Cu��OH��2+2H+���������������������ͭ��ˮ��
Cu��OH��2+2H+���������������������ͭ��ˮ�� Cu��OH��2+2H+���������������������ͭ��ˮ��
Cu��OH��2+2H+���������������������ͭ��ˮ��
 NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18��Cu��Һ̬N2O4��Ӧ�Ƶ���ˮ����ͭ�Ļ�ѧ����ʽ��
NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18��Cu��Һ̬N2O4��Ӧ�Ƶ���ˮ����ͭ�Ļ�ѧ����ʽ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
 NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18����Һ̬N2O4����ķ���ʽ��
NH4++NH2-���ɴ��Ʊ���ˮ����ͭ�ķ���֮һ����Cu��Һ̬N2O4��Ӧ��Һ̬N2O4����õ������������������������18����Һ̬N2O4����ķ���ʽ��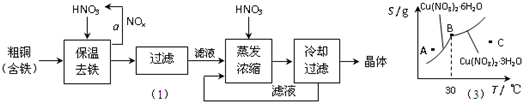
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
| H | + 4 |
| H | - 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(ѡ�ޡ���ѧ�뼼��)��15�֣�
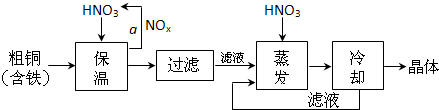
��1����ҵ���Դ�ͭΪԭ�ϲ�ȡ��ͼ1��ʾ�����Ʊ�����ͭ���壺
���ڲ���a�У�����Ҫͨ��������ˮ����Ŀ���� ��
���ڱ���ȥ���Ĺ����У�ΪʹFe3+������ȫ�������±����ݣ���Һ��pHֵӦ������ ��Χ������pHֵʱ����������Һ�м�����Լ��ǣ� ��
(a) NaOH��Һ (b) ��ˮ (c) Cu(OH)2 (d) CuO
|
| �������↑ʼ����ʱ��pH | �������������ȫʱ��pH |
| Fe3+ Cu2+ | 1.9 4.7 | 3.2 6.7 |
���ڲ�����֮ǰ������Һ��HNO3����pHֵ��1����Ŀ���ǣ�������ӷ���ʽ˵���� ��
�ܴ���Һ����ȡ����ͭ����IJ�����ľ��岽���� ��
��2��ͼ2��ijС��ѧ���������Ϻ������������ͭ����[Cu(NO3)2nH2O]���ܽ�����ߣ��¶���300C���Ҷ�Ӧ��ͬ�ľ��壩������˵����ȷ���ǣ� ��
(a) A��ʱ����ҺΪ��������Һ
(b) B��ʱ���־�����Թ���
(c)�������������յõ��ľ���һ����Cu(NO3)2 3H2O
(d) ����C��ʱ����Һ������300C���£���������Cu(NO3)2 6H2O����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com