
| A. | v(H2)=v(N2)=v(NH3) | B. | v(H2)=3 v(N2) | C. | v(N2)=2 v(NH3) | D. | 2v(NH3)=3v(H2) |
分析 根据速率之比等于化学计量数之比进行判断.
解答 解:对反应3H2+N2?2NH3.
A、速率之比等于化学计量数之比,所以v(H2):v(N2):v(NH3)=3:1:2,故A错误;
B、速率之比等于化学计量数之比,所以v(H2):v(N2)=3:1,即v(H2)=3v(N2),故B正确;
C、速率之比等于化学计量数之比,所以v(N2):v(NH3)=1:2,即2v(N2)=v(NH3),故C错误;
D、速率之比等于化学计量数之比,所以v(H2):v(NH3)=3:2,即3v(NH3)=2v(H2),故D错误.
故选:B.
点评 本题考查反应速率规律,旨在考查学生对基础知识的注意,细心推算,难度较小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
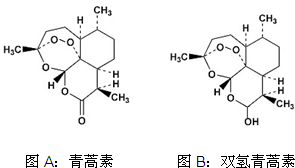 中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )
中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.下列有关青蒿素和双氢青蒿素(结构分别为图A、图B)的说法中不正确的是( )| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧键和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9g D2O中含有的电子数为5NA | |
| B. | 标准状况下,11.2 L Br2所含的分子数为0.5NA | |
| C. | 7.1g Cl2与足量NaOH溶液反应转移的电子数为0.2NA | |
| D. | 0.1mol CH4所含的电子数为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
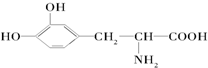 .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究结果.L多巴分子中不含有的官能团是( )| A. | 羟基 | B. | 氨基 | C. | 羧基 | D. | 醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L 1mol/L Na2SO4溶液中离子总数为3NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的原子数为3NA | |
| D. | 78g Na2O2与足量水充分反应时电子转移数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
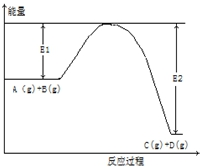 反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体和溶液、悬浊液的本质区别是它们分散质粒子的大小 | |
| B. | 光线透过胶体时,胶体发生丁达尔效应 | |
| C. | 布朗运动是胶体粒子特有的运动形式,可以据此把胶体和溶液、悬浊液区别开来 | |
| D. | Fe(OH)3胶体粒子具有较大的表面积,能吸附阳离子,故在电场作用下会定向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com