
 CO(g)��Cl2(g)����H<0 �����й�˵����ȷ����(����)
CO(g)��Cl2(g)����H<0 �����й�˵����ȷ����(����)| A����һ�������£�ʹ�ô����ܼӿ췴Ӧ���ʲ���߷�Ӧ���ƽ��ת���� |
| B������Ӧ��ƽ��ʱ�����º�ѹ������ͨ��Ar�������COCl2��ת���� |
| C����λʱ��������CO��Cl2�����ʵ���֮��Ϊ1��1ʱ����Ӧ�ﵽƽ��״̬ |
| D��ƽ��ʱ�������������䣬�����¶ȿ�ʹ�÷�Ӧ��ƽ�ⳣ������ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
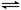 2C(g)���ﵽƽ��ָ����¶ȡ������й�˵������ȷ����
2C(g)���ﵽƽ��ָ����¶ȡ������й�˵������ȷ����
| A����ƽ�����K����ͣ�������̶�0��2֮�� |
| B����ƽ��ʱKͣ�������1���������ͣ�����Ҳ�6�� |
| C���ﵽƽ��ʱ����������B�����ʵ���С������������B�����ʵ��� |
| D�����ݸ���K���������ж��������ߵķ�Ӧ�Ƿ�ﵽƽ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Y(g)+Z(s)��������˵����Ӧ�ﵽƽ���־����
Y(g)+Z(s)��������˵����Ӧ�ﵽƽ���־����| A����������ѹǿ���ٱ仯 |
| B��X��Y��Z�����ʵ���֮��Ϊ2��1��1 |
| C����λʱ��������lmolY��ͬʱ�ֽ�2mol X |
| D��X�ķֽ�������Y������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H����92.4kJ/mol����һ���º�ѹ���ܱ����������2mol N2��8mol H2�ﵽƽ��ʱ����1mol NH3��������ͬ�����µ�ͬһ�����г���xmol N2��ymol H2��2mol NH3���ﵽƽ��ʱ��NH3������������ԭ����ͬ���ҷų�����46.2kJ����x��y��ֵΪ
2NH3��g������H����92.4kJ/mol����һ���º�ѹ���ܱ����������2mol N2��8mol H2�ﵽƽ��ʱ����1mol NH3��������ͬ�����µ�ͬһ�����г���xmol N2��ymol H2��2mol NH3���ﵽƽ��ʱ��NH3������������ԭ����ͬ���ҷų�����46.2kJ����x��y��ֵΪ| A��5��21 | B��3��13 | C��2��8 | D��1.5��6.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʱ��(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)(mol/L) | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)(mol/L) | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
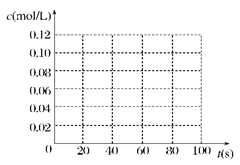
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����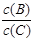 ��________��
��________���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2 SO3(g) ��H����Q kJ��mol��1��Q��0����������˵����ȷ����
2 SO3(g) ��H����Q kJ��mol��1��Q��0����������˵����ȷ����| A����λʱ��������2molSO2��ͬʱ����1molO2��˵����Ӧ�ﵽƽ��״̬ |
| B����2molSO2(g)��1mol O2(g)����һ�ܱ������г�ַ�Ӧ��ų�Q kJ������ |
| C�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С�������Ȼ�ѧ����ʽ�е�Qֵ��С |
| D�������Ȼ�ѧ��Ӧ����ʽ˵����Ӧ����ܼ���С����������ܼ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)��H2O(g)��ƽ�ⳣ��K���±���
CO(g)��H2O(g)��ƽ�ⳣ��K���±���| �¶�/�� | 700 | 800 | 850 | 1000 | 1200 |
| ƽ�ⳣ��K | 2.6 | 1.7 | 1 | 0.9 | 0.6 |

| | A | B | C | D | E |
| n(CO2)[ | 3 | 1 | 0 | 1 | 1 |
| n(H2) | 2 | 1 | 0 | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 0.5 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)����2molSO3���ų�393.2kJ���������ڸ��¶��£����1����һ�̶��ݻ����ܱ�������ͨ��2molSO2��1molO2���ﵽƽ��ʱ���ų�����ΪQ1�����2������һ�ݻ���ͬ���ܱ�������ͨ��1molSO2��0.5mol O2���ﵽƽ��ʱ�ų�����ΪQ2���������жϲ���ȷ���ǣ� ��
2SO3(g)����2molSO3���ų�393.2kJ���������ڸ��¶��£����1����һ�̶��ݻ����ܱ�������ͨ��2molSO2��1molO2���ﵽƽ��ʱ���ų�����ΪQ1�����2������һ�ݻ���ͬ���ܱ�������ͨ��1molSO2��0.5mol O2���ﵽƽ��ʱ�ų�����ΪQ2���������жϲ���ȷ���ǣ� ��| A��ͬʱ����ʱ�����1�ķ�Ӧ����(SO2)�����2�Ĵ� |
| B��ƽ��ʱ�����1��Q=393.2kJ |
| C���ﵽƽ��ʱ�����������ܶȣ����1�����2�� |
| D��ƽ��ʱ�����2��Q<196.6kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com