
分析 (1)化合价升高元素失去电子,被氧化,所在反应物是还原剂,对应产物是氧化产物;化合价降低元素得到电子,被还原,所在的反应物是氧化剂,对应产物是还原产物;
(2)根据化学方程式的系数来回答;
(3)根据化学方程式以及反应转移电子的情况计算即可.
解答 解:(1)高锰酸钾中的锰元素处于最高价,只有氧化性,能将HCl氧化,HCl是还原剂,对应的产物Cl2是氧化产物,故答案为:KMnO4; Cl2;
(2)根据电子守恒配平高锰酸钾氧化HCl的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,氧化产物是氯气,还原产物是MnCl2,物质的量之比为5:2,故答案为:5:2;
(3)根据化学方程式:2KMnO4+16HCl(浓)=2MnCl2+8H2O+2KCl+5Cl2,当生成5mol的氯气时,消耗高锰酸钾2mol,转移电子10mol,当产生的气体在标准状况下体积为2.24L,即生成氯气是0.1mol时,消耗高锰酸钾0.04mol,则反应过程中转移电子0.2mol,即0.2NA个,发生反应的KMnO4的质量为0.04mol×158g/mol=6.32g,故答案为:0.2;6.32.
点评 本题考查学生氧化还原反应中的基本概念和电子转移知识,综合性较强,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④ | C. | ①②④ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| B. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1 059.3 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=+1 076.7 kJ/mol | |
| D. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-538.35kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
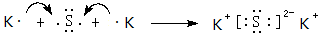 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为推广氢能的使用,工业上可采用电解水法制取大量氢气 | |
| B. | 将石油裂化、裂解,综合利用石油资源 | |
| C. | 有节制地开采煤、石油、天然气等矿物资源 | |
| D. | 将某些废旧塑料熔化后再成型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

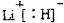 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、SiO32-、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入石蕊显蓝色的溶液:Cu2+、Al3+、NO3-、SO42- | |
| D. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 O2 | B. | Al(OH)3 AlCl3 | C. | FeCl3 Fe(OH)3 | D. | NaOH Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com