
| A. | 反应后溶液中Fe3+物质的量为0.6mol | |
| B. | 反应后产生13.44L H2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.8mol | |
| D. | 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
分析 Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3-═Fe3++NO↑+2H2O、再发生Fe+2Fe3+═3Fe2+,若还有Fe剩余,则最后发生Fe与氢离子的反应,以此来解答.
解答 解:Fe(NO3)3和H2SO4的物质的量分别为0.2mol、1.5mol,n(Fe)=$\frac{39.2g}{56g/mol}$=0.7mol,氧化性为HNO3>Fe3+>H+,则:
Fe+4H++NO3-═Fe3++NO↑+2H2O
1 4 1 1
0.6 2.4 0.6 0.6
Fe+2Fe3+═3Fe2+,
1 2 3
0.1 0.2 0.3
Fe完全反应,没有剩余,溶液中存在0.6molFe3+、0.3molFe2+,
A.反应后溶液中Fe3+物质的量为0.6mol,故A正确;
B.不发生Fe+2H+═Fe2++H2↑,没有氢气生成,故B错误;
C.反应后溶液中存在0.6molFe3+、0.3molFe2+,反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol,故C错误;
D.氧化性为HNO3>Fe3+>H+,先发生Fe+4H++NO3-═Fe3++NO↑+2H2O,有气体生成,故D错误;
故选A.
点评 本题考查铁的化学性质及化学反应的计算,题目难度中等,明确发生的化学反应及反应的先后是解答本题的关键,注意过量计算来解答,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:多选题
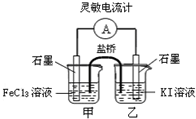
| A. | 反应开始时,乙中电极反应为2I-+2e-═I2 | |
| B. | 反应开始时,甲中石墨电极上发生氧化反应 | |
| C. | 电流表指针为零时,两池溶液颜色相同 | |
| D. | 平衡时甲中溶入FeCl2固体后,乙池的石墨电极为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | 乙酸中含有的官能团为羟基 | |
| C. | C的名称为乙酸乙酯 | |
| D. | 过量饮用B会对人体造成伤害 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ④⑤ | C. | ④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,它对应的水化物是硅酸(H2SiO3) | |
| B. | 硅酸可由SiO2跟水反应制得 | |
| C. | SiO2可与碱性氧化物或强碱反应 | |
| D. | 光导纤维的主要原料就是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 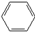 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$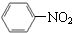 +H2O +H2O | |
| D. | CH3COOH+HOCH2CH3$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
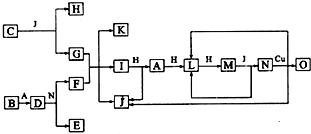
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com