
【题目】Na2O+H2O=2NaOH的反应类型属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。若向1L1mol·L-1的NaOH溶液中分别加入:①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,则上述过程中放出的热量等于57.3kJ的是( )
A.①B.②C.③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
以苯和乙炔为原料合成化工原料E的路线如下:
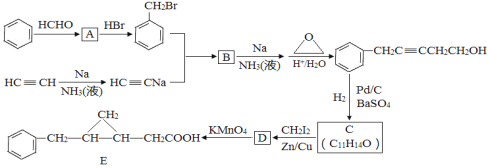
回答下列问题:
(1)A的名称___________________。
(2)生成B的化学方程式为____________________________,反应类型是________。
(3)C的结构简式为____________,C的分子中一定共面的碳原子最多有_____个。
(4)与D同类别且有二个六元环结构(环与环之间用单键连接)的同分异构体有______种,请任写两种同分异构体的结构简式:_____________________________。
(5)参照上述合成路线,设计一条以乙炔和必要试剂合成环丙烷的路线:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫、钴及其相关化合物用途非常广泛。回答下列问题:
(1)基态Co原子价电子轨道排布式为________,第四电离能I4(Co) < I4(Fe),其原因是______________________________;Co 与Ca同周期且最外层电子数相同,单质钴的熔沸点均比钙大,其原因是___________________________________________________.
(2)单质硫与熟石灰加热产物之一为CaS3,S32-的几何形状是_______,中心原子杂化方式是_______,与其互为等电子体的分子是_______ (举1例)。
(3)K 和Na位于同主族,K2S的熔点为840℃,Na2S的熔点为950℃,前者熔点较低的原因是___________________________________________________________________ 。
(4)S与O、Se、Te位于同一主族,它们的氢化物的沸点如图所示,沸点按图像所示变为的原因是_______ 。

(5)钴的一种化合物晶胞结构如下图所示。

①已知A点的原子坐标参数为为(0,0,0),B点为(1/2,0,1/2),则C点的原子坐标参数为_____。
②已知晶胞参数为a=0.5485nm,则该晶体的密度为_____g/cm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
又知形成或拆开1 mol化学键放出或吸收的能量称为该化学键的键能。P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A. P-P键的键能大于P-Cl键的键能
B. 可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C. Cl-Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D. P-P键的键能为(5a-3b+12c)/8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知t℃时AgCl的Ksp=4×10-10,下列说法正确的是
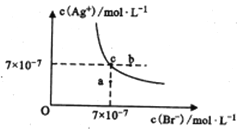
A. 图中a点对应的体系中将有AgBr沉淀生成
B. 加入NaBr固体,AgBr的溶解度减小,AgBr的Ksp也减小
C. 在AgBr饱和溶液中加入固体NaBr,可使溶液中c点变到b点
D. 在t℃时,AgCl(s)+Br-(aq) ![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe+H2SO4 ═ FeSO4+H2↑的能量变化趋势,如图所示:
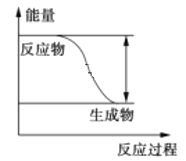
(1)该反应为______反应(填“吸热”或“放热”)
(2)若要使该反应的反应速率加快,下列措施可行的是______(选填A、B、C)。
A.改铁片为铁粉 B.改稀硫酸为98%的硫酸溶液 C.升高温度
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”),铜片上产生的现象为______,该极上发生的电极反应为______,消耗5.6g Fe时转移的电子数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氡(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O![]() NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
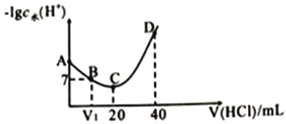
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等
B. A点对应溶液的pH=9.5
C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C点时,溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com