
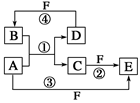
 ________________________________________。
________________________________________。 质,且反应①在水溶液中进行。
质,且反应①在水溶液中进行。 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:单选题







查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
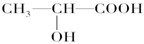
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | A | B | C | D |
| 原子半径(nm) | 0.130 | 0.118 | 0.090 | 0.102 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 |
| 元素 | E | F | G | H |
| 原子半径(nm) | 0.073 | 0.154 | 0.037 | 0.099 |
| 主要化合价 | -2 | +1 | +1 | +7,-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。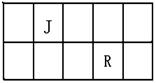
 。
。 潮湿的空气中冒白色烟雾,反应的化学方程式为___ __。
潮湿的空气中冒白色烟雾,反应的化学方程式为___ __。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。
(5)在一定温度下,将4 mol C单质和12 mol A单质通入到体积为2L的密闭容器中,发生反应,2 min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为 ;该温度下的平衡常数为K= 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com