
下列叙述正确的是( )
|
| A. | 常温常压下,4.6g NO2气体约含有1.81×1023个原子 |
|
| B. | 在标准状况下,80g SO3所占的体积约为22.4L |
|
| C. | 常温下,0.1mol•L﹣1醋酸溶液的pH约为1 |
|
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
| 物质的量的相关计算. | |
| 专题: | 计算题. |
| 分析: | A.根据N=nNA=NA结合分子构成计算原子个数; B.标况下,三氧化硫是固体; C.醋酸是弱电解质,在水溶液中存在电离平衡; D.Cl2+2NaOH=NaCl+NaClO+H2O中氯气既是氧化剂又是还原剂,且氯气和转移电子之间的关系式为1:1. |
| 解答: | 解:A.二氧化氮能转化为四氧化二氮,四氧化二氮的相对分子质量、原子个数是二氧化氮的2倍,把气体当作二氧化氮计算即可,二氧化氮分子个数N=nNA=NA= B.标况下,三氧化硫是固体,气体摩尔体积对其不适用,所以无法计算三氧化硫体积,故B错误; C.醋酸是弱电解质,在水溶液中存在电离平衡,所以常温下,0.1mol•L﹣1醋酸溶液的pH大于1,故C错误; D.Cl2+2NaOH=NaCl+NaClO+H2O中氯气既是氧化剂又是还原剂,且氯气和转移电子之间的关系式为1:1,标准状况下,22.4L氯气的物质的量为1mol,与足量氢氧化钠溶液反应,转移的电子数为NA,故D错误; 故选A. |
| 点评: | 本题考查了物质的量的有关计算,涉及弱电解质的电离、物质之间的反应等知识点,注意A中即使二氧化氮转化为四氧化二氮也不改变原子个数,注意气体摩尔体积的适用范围及适用条件,为易错点. |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)正四面体烷的分子式为________,其二氯取代产物有________种。
(2)关于乙烯基乙炔分子的说法错误的是:________
A.能使酸性KMnO4溶液褪色
B.1 mol乙烯基乙炔能与3 mol Br2发生加成反应
C.乙烯基乙炔分子内含有两种官能团
D.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:________。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式错误的是( )
A.(NH4)2SO4溶于水:(NH4)2SO4===2NH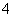 +SO
+SO
B.H3PO4溶于水:H3PO43H++PO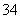
C.HF溶于水:HFH++F-
D.NaHS溶于水:NaHS===Na++HS-,HS-H++S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),使其达到分解平衡:NH2COONH4(s) 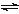 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/10-3mol/L | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A 该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B 因该反应熵变(△S)大于0,焓变(△H)大于0,所以在低温下自发进行
C根据表中数据,计算15.0℃时的分解平衡常数约为2.0×10-9(mol·L-1)3
D达到平衡后,若在恒温下压缩容器体积,氨基甲酸铵固体的质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下钛的化学活性很小,在较高温度下可与多种物质反应。
(1)工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:


① 沸腾氯化炉中发生的主要反应为: 。
② 已知:Ti(s) +2Cl2(g)=TiCl4(l) ΔH=a kJ·mol-1;
2Na(s) +Cl2(g)=2NaCl(s) ΔH=b kJ·mol-1;
Na(s)=Na(l) ΔH=c kJ·mol-1;
则:TiCl4(l) +4Na(l)=Ti(s) +4NaCl(s) ΔH= kJ·mol-1。
(2)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如下图所示,二氧化钛电极连接电源 极,该极电极反应为:
。但此法会产生有毒气体,为减少对环境的污染,在电池中加入固体氧离子隔膜(氧离子能顺利通过),将两极产物隔开,再将石墨改为金属陶瓷电极,并通入一种无毒的还原性气体,该气体是 。


(3)海绵钛可用碘提纯,原理为: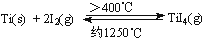 ,下列说法正确的是 。
,下列说法正确的是 。
A.该反应正反应的ΔH>0
B.在不同温度区域,TiI4的量保持不变
C.在提纯过程中,I2 的作用是将粗钛从低温区转移到高温区
D.在提纯过程中,I2 可循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列说法中正确的是( )
|
| A. | 1L 1mol•L﹣1的CH3COOH溶液中含有NA个氢离子 |
|
| B. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol•L﹣1 |
|
| C. | 0.1mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15NA |
|
| D. | VL CO和NO的混合气体中含有的氧原子个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些离子的检验及结论一定正确的是( )
|
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣ |
|
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ |
|
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
|
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某高聚物可表示为

下列有关叙述错误的是( )
A.该高聚物是通过加聚反应生成的
B.合成该高聚物的单体有3种
C.该物质能被酸性KMnO4溶液氧化
D.1 mol该物质与1 mol H2加成,生成不含 的物质
的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
用石墨电极电解含有一定量重水(D2O)的水(H2O),下列说法正确的是( )
A.相同状况下两电极上产生的气体体积之比为2:1
B.两电极产生的气体质量之比为8:1
C.相同状况下两电极上产生的气体体积之比为4:1
D.若两电极上产生的气体质量为16:3,则D2O与H2O的物质的量之比为2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com