
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值。如某溶液溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。下图为,H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC—pH图。请回答下列问题:

(1)在人体血液中,HC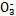 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
②正常人体血液中,HC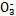 的水解程度 电离程度(填“<”“>”或“=”)。
的水解程度 电离程度(填“<”“>”或“=”)。
③pH=7.00的血液中,c(H2CO3) c(HC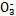 )(填“<”“>”或“=”)。
)(填“<”“>”或“=”)。
(2)H2CO3一级电离平衡常数的数值 ≈ 。
≈ 。
(3)某同学认为该溶液中Na2CO3的水解是微弱的,发生水解的C 不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
。
(4)已知某温度下Li2CO3的Ksp为1.68×10-3,将适量Li2CO3固体溶于100 mL水中至刚好饱和,饱和Li2CO3溶液中c(Li+)=0.15 mol·L-1、c(C )=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
)=0.075 mol·L-1。若t1时刻在上述体系中加入100 mL 0.125 mol·L-1 Na2CO3溶液,列式计算说明是否有沉淀产生。
(1)①HC
 H++C
H++C 、HC
、HC +H2O
+H2O H2CO3+OH- ②> ③<
H2CO3+OH- ②> ③<
(2)1
(3)用pH试纸(或pH计)测常温下0.1 mol·L-1 Na2CO3溶液的pH,若pH<12,该同学的观点正确;若pH>12,则该同学的观点错误
(4)c(Li+)=0.075 mol·L-1、c(C )=0.1 mol·L-1,c2(Li+)·c(C
)=0.1 mol·L-1,c2(Li+)·c(C )=5.6×1
)=5.6×1 <1.68×10-3,所以无沉淀产生
<1.68×10-3,所以无沉淀产生
【解析】(1)①依据信息抓住HC 既能水解也能电离分析;②由信息可知正常人体血液显碱性,所以水解大于电离;③由图像可知c(H2CO3)=c(HC
既能水解也能电离分析;②由信息可知正常人体血液显碱性,所以水解大于电离;③由图像可知c(H2CO3)=c(HC )时溶液显酸性,显中性时c(HC
)时溶液显酸性,显中性时c(HC )>c(H2CO3);(2)
)>c(H2CO3);(2) ,pH=6时c(H2CO3)=c(HC
,pH=6时c(H2CO3)=c(HC ),所以
),所以 =c(H+);(3)由C
=c(H+);(3)由C +H2O
+H2O HC
HC +OH-可知测一定浓度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的浓度;(4)注意最后溶液的体积为原体积的2倍。
+OH-可知测一定浓度的Na2CO3溶液中c(OH-)即可求出已水解的Na2CO3的浓度;(4)注意最后溶液的体积为原体积的2倍。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷(解析版) 题型:实验题
某小组取一定质量的FeSO4固体,利用下图装置进行实验。

实验 | 实验过程 | 实现现象 |
① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_____________________________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是____________________________________________________
(3)实验④反应的离子方程式是_____________________________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________________________________________(用必要的文字和化学方程式解释)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:实验题
某小组查文献得知:氧化性I >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2
 S4
S4 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
实验步骤 | 实验过程和现象 | 对应结论 | |
步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |
_____________ | |
步 骤 2 | 第①份 试液 |
| 碘盐中肯定含 |
第②份 试液 |
|
_____________ | |
第③份 试液 |
| X为 (填化学式) | |
(2)该碘盐中肯定不含的物质是 (用化学式或离子符号表达)。
(3)根据信息推断Fe3+、S4 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。
(4)第③份试液中加入足量KI固体后,反应的离子方程式为 、 。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
(1)滴定终点的现象是 。
(2)CuCl2溶液与KI反应的化学方程式为 。
(3)该试样中CuCl2·2H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液:Na+、K+、N 、NH3·H2O
、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、S 、葡萄糖分子
、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小
C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电化学练习卷(解析版) 题型:填空题
某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。


图1 图2
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是 (填字母序号)。
A.铝B.石墨C.银D.铂
(2)N极发生反应的电极反应为 。
(3)实验过程中,S (填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
(填“从左向右”“从右向左”或“不”)移动;滤纸上能观察到的现象有 。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(Fe )在溶液中呈紫红色。
)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大”“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH- Fe
Fe +4H2O和 。
+4H2O和 。
(6)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少 g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:
2K2FeO4+3Zn Fe2O3+ZnO+2K2ZnO2
Fe2O3+ZnO+2K2ZnO2
该电池正极发生的反应的电极反应为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 物质结构和元素周期律练习卷(解析版) 题型:选择题
下列判断中一定正确的是( )
A.若X、Y属于同主族元素,且相对原子质量:X>Y,则X失电子能力比Y强
B.若M+和 的核外电子层结构相同,则原子半径:R>M
的核外电子层结构相同,则原子半径:R>M
C.若X、Y都是气态氢化物,且相对分子质量:X>Y,则酸性:X>Y
D.若X、Y是同主族元素,且原子序数:X>Y,则非金属性:X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com