
| A. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| B. | 分别加水稀释100倍后,硫酸溶液的pH变化比醋酸溶液小 | |
| C. | 两种溶液中,由水电离出的c(H+)=1×10-11mol•L-1 | |
| D. | 分别加入足量铁片充分反应后,两溶液中产生的氢气一样多 |
分析 A、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-)+c(OH-),硫酸溶液中c(H+)=2c(SO42-)+c(OH-),据此判断;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子;
C、pH均为3的醋酸和硫酸,溶液中氢离子浓度为1×10-3mol/L,根据Kw=c(H+)•c(OH-)计算溶液中c(OH-);
D、酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的铁反应,醋酸提供的氢离子大于硫酸.
解答 解:A、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO-)+c(OH-),硫酸溶液中c(H+)=2c(SO42-)+c(OH-),由于两种溶液中c(H+)、c(OH-)分别相等,所以c(CH3COO-)=2c(SO42-),故A错误;
B、硫酸是强电解质,完全电离,醋酸是弱电解质,加水稀释,醋酸继续电离出氢离子,分别加水稀释100倍后,硫酸溶液的pH值为5,醋酸溶液的pH值小于5,所以硫酸溶液的pH变化比醋酸溶液大,故B错误;
C、pH均为3的醋酸和硫酸,溶液中氢离子浓度均为1×10-3mol/L,溶液中氢氧根浓度均为c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-3}}$=1×10-11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10-11mol•L-1,故C正确;
D、硫酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的铁反应,醋酸提供的氢离子大于硫酸,铁与醋酸反应产生的氢气大于与硫酸反应生成的氢气,故D错误;
故选C.
点评 本题考查弱电解质的电离、溶液pH的有关计算等,题目难度不大,注意弱电解质的电离存在平衡,电离程度很小,侧重于考查学生的分析能力.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:选择题

| A. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -=Fe2+ | |
| C. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X的一个分子中有32个氢原子 | B. | X的一个分子中含有三个 | ||
| C. | X是一种醇 | D. | X不能使溴的CCl4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol
已知NO2与N2O4相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol| A. | a,b,c,d四点中c正与v逆均相等 | |
| B. | 反应进行到10min时,体系吸收的热量为9.68kJ | |
| C. | 前10min内,用v(NO2)表示的该反应速率为0.02mol/L•min | |
| D. | 25min时,导致平衡移动的原因是升温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
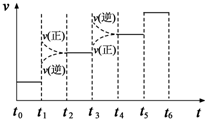 氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0
氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com