
| A. | 铝 | B. | 硅 | C. | 磷 | D. | 硫 |
分析 同一周期元素,元素的第一电离能随着原子序数的增大而增大,但同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大,以此解答该题.
解答 解:同一周期元素,元素的第一电离能随着原子序数的增大而增大,但同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大,铝、硅、磷、硫属于同一周期且其原子序数依次增大,但磷属于第VA元素,硫属于第ⅥA族,所以铝、硅、磷、硫几种元素的第一电离能的大小顺序是磷、硫、硅、铝,
故选C.
点评 本题考查了同一周期元素第一电离能大小的判断,为高频考点,侧重于学生的分析能力的考查,注意同一周期中第ⅡA族元素比第ⅢA族元素的第一电离能大,第ⅤA族比第ⅥA族第一电离能大的特点,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1装置制取并收集干燥纯净的NH3 | |
| B. | 用图2装置可演示NO的喷泉实验 | |
| C. | 用图3装置制备Fe(OH)2并能较长时间观察其颜色 | |
| D. | 用图4装置验证苯中是否有独立的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.2mol•L-1 醋酸 | B. | 0.1L 0.1mol•L-1 H2SO4溶液 | ||
| C. | 0.5L 0.1mol•L-1 盐酸 | D. | 2L 0.1mol•L-1 H2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
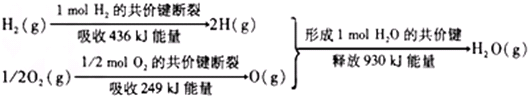
| A. | 氢气跟氧气反应生成水的同时释放能量 | |
| B. | 氢气跟氧气反应生成水的同时吸收能量 | |
| C. | 1 mol H2跟1/2 mol O2反应生成1 mol H2O释放能量不一定是245 kJ | |
| D. | 2 mol H2(g)跟1 mol O2(g)反应生成2 mol H2O(g)释放能量490 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.1 mol/L CH3COONa溶液中,CH3COO-个数小于0.1NA | |
| B. | K、Zn分别与稀硫酸反应所得溶液均呈中性 | |
| C. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该离子反应配平后H2O的系数22 | |
| B. | MnO4-是氧化剂,既Cu2S是氧化剂又是还原剂 | |
| C. | 氧化性:MnO4-<Cu2+ | |
| D. | 生成2.24L(标况下)SO2时反应中转移电子的物质的量是0.6 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 珍珠、玛瑙、红宝石、水晶的主要成分都是硅酸盐 | |
| B. | 工业上冶炼金属Mg、Cu都采用热还原法 | |
| C. | 氯水、醋酸、小苏打都是电解质 | |
| D. | 利用丁达尔效应可以区别NaCl溶液和Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com