
| A. | 3:1 | B. | 3:2 | C. | 1:2 | D. | 6:1 |
分析 发生反应:2Al+6HCl=AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,产生相同物质的量的氢气时,则n(HCl):n(NaOH)=6:2=3:1,因为物质的量浓度相同,因此消耗的HCl、NaOH的体积之比等于其物质的量之比.
解答 解:发生反应:2Al+6HCl=AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,产生相同物质的量的氢气时,则n(HCl):n(NaOH)=6:2=3:1,因为物质的量浓度相同,因此消耗的HCl、NaOH的体积之比:v(HCl):v(NaOH)=n(HCl):n(NaOH)=3:1,
故选:A.
点评 本题考查物质的量在化学反应方程式计算中的应用及金属铝的性质,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | W与Y可形成既含极性共价键又含非极性共价键的化合物 | |
| B. | W、X、Y、Z原子的核外最外层电子数的总和为20 | |
| C. | 上述四种元素的原子半径大小为W<X<Y<Z | |
| D. | 由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):
如图是某医院输液用的一瓶葡萄糖注射液标签的部分内容.据此回答以下问题(答案保留2位小数):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L二氯甲烷的分子数约为NA个 | |
| B. | 常温下,在18g18O2中含有NA个氧原子 | |
| C. | 1 mol乙烷中含有C一H的键数为7×6.02×l023 mol-1 | |
| D. | 1mol-OH所含的电子数目为7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,镁与水反应的速率越快 | |
| B. | 镁与水反应的化学方程式为:Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 氢氧化镁显碱性,且在水中有一定的溶解性 | |
| D. | 氢氧化镁是离子化合物,它的电子式可表示为: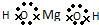 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 标准状况下,11.2 L的SO3所含分子数为0.5NA | |
| D. | 室温下,8 g甲烷含有共价键数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com