
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)$?_{500℃,30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ?mol-1 | |
| C. | 已知:H2(g)+F2(g)═2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
分析 A、燃烧热是指1mol可燃物完全燃烧生成稳定氧化物放出的热量,方程式水为液体;
B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ.
C、从物质的状态对能量的影响的角度来分析.
D、反应吸放热由反t应物和生成物的总能量的大小关系决定.
解答 解:A、甲烷的标准燃烧热为-890.3kJ•mol-1,表示1mol甲烷完全燃烧生成二氧化碳与液态水放出热量为890.3kJ,甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3kJ•mol-1,故A错误;
B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g),放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C、从热化学方程式H2(g)+F2(g)=2HF(g)△H=-270 kJ/mol,可知1 mol氢气与1 mol氟气反应生成2 mol氟化氢气体时放出的热量为270 kJ,故当生成能量更低的液态HF时,放出的热量要多于270 kJ,故C错误;
D、从热化学方程式H2(g)+F2(g)=2HF(g)△H=-270 kJ/mol可知,反应放热,即1 mol氢气与1 mol氟气的总能量大于2 mol氟化氢的总能量,故D正确.
故选D.
点评 本题考查了燃烧热的定义、可逆反应对反应热的影响以及物质状态对反应热的数值的影响,难度适中.


科目:高中化学 来源: 题型:选择题
| A. | M为H2O | |
| B. | 每还原1 mol氧化剂,就有3 mol电子转移 | |
| C. | 还原性:SnCl2>As | |
| D. | 氧化产物和还原产物的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
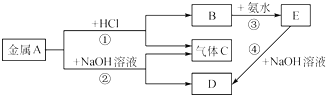
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 0.2mol•L-1 的 NaCl 溶液 | |
| B. | 100mL 0.1mol•L-1 的 NaCl 溶液 | |
| C. | 25mL 0.2mol•L-1 的 Na2SO4 溶液 | |
| D. | 10mL 0.5mol•L-1 的 Na2CO3 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液 | B. | 稀硝酸 | C. | 盐酸 | D. | 硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
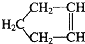 可简写为
可简写为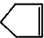 降冰片烯的分子结构可表示为:
降冰片烯的分子结构可表示为: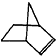
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与铜粉反应:Cu+Fe3+═Fe2++Cu2+ | |
| B. | 稀HNO3与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO${\;}_{4}^{2-}$═BaSO4↓ | |
| D. | 碳酸氢钙与盐酸反应:HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2与Cl2 | B. | Ba(OH)2与H2SO4 | C. | HCl与Na2CO3 | D. | Ca(HCO3)2与NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 C2H4 C3H4 | B. | CH4 C2H6 C2H2 | C. | C2H2 C2H4 C3H4 | D. | C2H2C3H6 C4H8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com