

分析 (1)由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI;
(2)①分成两层,与溶解性、密度有关;
②两层的颜色不同;
③H2SO4中c(H+):c(SO42-)=2:1,且HI电离出氢离子;
(3)①由图可知,X越大,转化率越低;
②分解反应为吸热反应,温度高,转化率大.
解答 解:(1)由图可知,反应I为二氧化硫与碘发生氧化还原反应生成硫酸和HI,该反应为SO2+2H2O+I2=H2SO4+2HI,故答案为:SO2+2H2O+I2=H2SO4+2HI;
(2)①a.两层溶液的密度存在差,才出现上下层,故a正确;
b.加I2前,H2SO4溶液和HI溶液互溶,与分层无关,故b错误;
c.I2在HI溶液中比在H2SO4溶液中易溶,则碘在不同溶剂中溶解性不同,类似萃取,与分层有关,故c正确;
故答案为:ac;
②辨别两层溶液的方法是观察颜色,颜色深的为HI层,颜色浅的为硫酸层,故答案为:观察颜色,颜色深的为HI层,颜色浅的为硫酸层;
③H2SO4层中c(H+):c(SO42-)=2.06:1.其比值大于2的原因是硫酸层中含少量的I,且HI电离出氢离子,故答案为:硫酸层中含少量的I,且HI电离出氢离子;
(3)①由图可知,X越大,转化率越低,升高温度转化率增大,则X表示压强,故答案为:压强;
②由SO3(g)=SO2(g)+O2(g)△H>0,温度高,转化率大,图中等压强时L2对应的转化率大,则L1<L2,故答案为:L1<L2,分解反应为吸热反应,温度高,转化率大.
点评 本题考查混合物分离提纯及化学平衡等,为高频考点,把握发生的反应、平衡影响因素为解答的关键,侧重分析与应用能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{16}{n}$ | B. | n | C. | 16n | D. | 32n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 1 mol•L-1 NaNO3 溶液 | B. | 10 mL 1 mol•L-1Al(NO3)3 溶液 | ||
| C. | 15 mL 2 mol•L-1 AgNO3 溶液 | D. | 10 mL 1.5 mol•L-1Cu(NO3)2 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的反应原理和实验装置如下:
实验室制备硝基苯的反应原理和实验装置如下: ,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:
,存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.有关数据列如下表:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
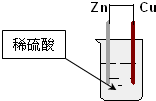
| A. | 铜片表面有气泡产生 | B. | 负极反应为:Cu-2e-=Cu2+ | ||
| C. | 锌为负极,铜为正极 | D. | 电子通过锌片经导线流向铜片 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com