
| A. | 2NaHCO3═Na2CO3+CO2↑+H2O | B. | MnO2+4 HCl(浓)═MnCl2+Cl2↑+2 H2O | ||
| C. | 2 H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2 H2O+O2↑ | D. | Na2CO3+CaCl2═CaCO3↓+2NaCl |
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1 | B. | 0.5mol•L-1 | ||
| C. | 22.4mol•L-1 | D. | 缺少密度无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液的浓度 (mol•L-1) | 溶液褪色所需时间 (min) | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
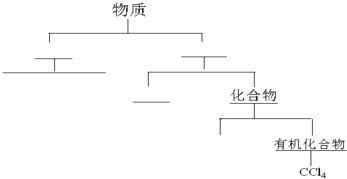
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、NO3-、SO42- | B. | Na+、H+、AlO2-、HCO3- | ||
| C. | Ca2+、Fe3+、CO32-、CH3COO- | D. | Ca2+、Na+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中:2c(Ca2+)=c(NO3-) | |
| B. | 将0.2 mol•L-1NaA溶液和0.1 mol•L-1盐酸等体积混合所得的碱性溶液中(A-为酸根离子): c(Na+)>c(A-)>c(C1-)>c(OH-) | |
| C. | 0.1 mol/LNaAlO2溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH、CH3COONa的混合溶液中:2c(OH-)=2c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液中滴入硝酸银溶液 | B. | 金属钠在氯气中燃烧生成氯化钠 | ||
| C. | 铁片置于硫酸铜溶液中 | D. | 氢氧化钠溶液与稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com