��2011?����һģ���±��Dz��ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ�
| Ԫ�ش��� |
W |
R |
X |
Y |
Z |
Q |
M |
| ԭ�Ӱ뾶/nm |
0.037 |
0.186 |
0.074 |
0.075 |
0.077 |
0.110 |
0.160 |
| ��Ҫ���ϼ� |
+1 |
+1 |
-2 |
-3��+5 |
+2��+4 |
-3��+5 |
+2 |
�Իش��������⣺
��1������Ԫ����ԭ�Ӱ뾶����Ԫ�������ڱ���λ����
�������ڵڢ�A��
�������ڵڢ�A��
��M��Z�������������ȼ�յĻ�ѧ����ʽΪ
��
��2��X����R��1��l��ԭ�Ӹ������γɻ�����ף����д��ڵĻ�ѧ����
���Ӽ������ۼ�
���Ӽ������ۼ�
��X����w��ɺ�18���ӵĻ������ң����ҵĵ���ʽΪ
��
��3��M������������ˮ����������ˮ����֪298Kʱ�������ʵ�K
SP=5.6��10
-12������ʱ�����ҺpH=13.00������¶��²�������Һ�е�M�������ʵ���Ũ��Ϊ
5.6��10-10
5.6��10-10
mol?L
-1��
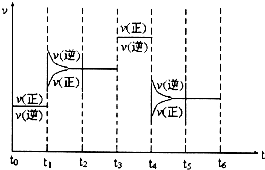
��4����ѧ��Ӧ3W
2��g��+Y
2��g��=2YW
3��g������H��0������Ӧ�ﵽƽ��ʱ���ϸı����������ı�Y
2��W
2��YW
3����������ͼ��ʾ��Ӧ�����뷴Ӧ���̵Ĺ�ϵ�����б�ʾƽ��������YW
3�ĺ�����ߵ�һ��ʱ����
t0��t1
t0��t1
��

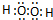
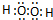

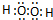 ��
�� ��
��


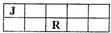 ��2011?����һģ��J��M��R��T��ԭ��������������Ķ���������Ԫ�أ�J��R�����ڱ��е����λ�����ұ�����֪��JԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ�M�ǵؿ��к������Ľ���Ԫ�أ�����˵��������ǣ�������
��2011?����һģ��J��M��R��T��ԭ��������������Ķ���������Ԫ�أ�J��R�����ڱ��е����λ�����ұ�����֪��JԪ��������ϼ۵ľ���ֵ����ԭ��������������ȣ�M�ǵؿ��к������Ľ���Ԫ�أ�����˵��������ǣ�������