
【题目】室温下向10mL0.1mol/LNaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点溶液中:c(Na+)>c(A-)>c(H+)>c(HA)
B.a、c两点溶液中水的电离程度相同
C.b点溶液中:c(Na+)=c(A-)+c(HA)
D.c点溶液中:c(A-)>c(HA)
【答案】D
【解析】
室温下向![]() NaOH溶液中加入
NaOH溶液中加入![]() 的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;
的一元酸HA,a点酸碱的物质的量相等,二者恰好反应生成NaA,但溶液呈碱性,说明生成的盐是强碱弱酸盐,则HA是弱酸;
要使混合溶液呈中性,则HA应该稍微过量,所以b点HA体积大于10mL,c点溶液中溶质为等物质的量浓度的NaA、HA,溶液呈酸性,说明HA电离程度大于![]() 水解程度;
水解程度;
A.a点时酸碱恰好中和,溶液![]() ,说明HA为弱酸,NaA溶液水解呈碱性,应为
,说明HA为弱酸,NaA溶液水解呈碱性,应为![]() ,选项A错误;
,选项A错误;
B.a点![]() 水解,促进水的电离,c点时HA过量,溶液呈酸性,HA电离出
水解,促进水的电离,c点时HA过量,溶液呈酸性,HA电离出![]() ,抑制水的电离,选项B错误;
,抑制水的电离,选项B错误;
C.![]() 时,
时,![]() ,由电荷守恒可知
,由电荷守恒可知![]() ,则
,则![]() ,选项C错误;
,选项C错误;
D.c点HA过量一倍,溶液存在NaA和HA,溶液呈酸性,说明HA电离程度大于![]() 水解程度,则存在
水解程度,则存在![]() ,选项D正确;
,选项D正确;
答案选D。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项表述与示意图一致的是:

A.图①中a、b曲线分别表示反应CH2=CH2(g)+H2(g) → CH3CH3(g)ΔH<0;使用和未使用催化剂时,反应过程中的能量变化
B.图②表示25 ℃时,用0.01 mol·L-1盐酸滴定一定体积的0.01 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
C.图③表示CH4(g)+H2O(g) ![]() CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
CO(g)+3H2(g)ΔH,反应CH4的转化率与温度、压强的关系,且p1>p2,ΔH<0
D.图④ 中曲线表示反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH <0;正、逆反应的平衡常数K随温度的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)![]() Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
Ni(CO)4(g),△H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
A. 增加Ni的量可提高CO的转化率,Ni的转化率降低
B. 缩小容器容积,平衡右移,△H减小
C. 反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D. 当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍的性质类似于铝,下列有关铍性质的推断中,正确的是( )
A.铍能与冷水反应
B.氢氧化铍既可以与盐酸反应又可与NaOH溶液反应
C.氧化铍的化学式为Be2O3
D.氧化铍只溶于强酸溶液,不溶于强碱溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液一定呈酸性的是
A.一定体积![]() 的NaOH溶液加水稀释
的NaOH溶液加水稀释![]() 倍
倍
B.![]()
![]() 某碱溶液和
某碱溶液和![]()
![]() 盐酸等体积混合
盐酸等体积混合
C.![]()
![]() 氨水和
氨水和![]()
![]() 氯化铵溶液等体积混合
氯化铵溶液等体积混合
D.![]() 的NaOH溶液与
的NaOH溶液与![]() 的
的![]() 溶液等体积混合
溶液等体积混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅及其化合物在工业生产、生活中具有非常广泛的用途。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
①2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H1=akJ·mol-1
②PbS(s)2PbO(s)=3Pb(s)+SO2(g) △H2=b kJ·mol-1
③PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H3=c kJ·mol-1
反应3PbS(s)+6O2(g)=3PbSO4(s) △H=____________kJ·mol-1(用含a、b、c的代数式表示)
(2)以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:
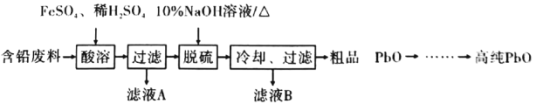
①“酸溶”时,在Fe2+催化下,Pb和PbO2反应成1 mol PbSO4时转移电子的物质的量为_________ mol。
②已知:PbO溶解在NaOH溶液中,存在化学平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图1所示:
NaHPbO2(aq),其溶解度曲线如图1所示:

结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_______________(填 “趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(3)将粗品PbO溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图2所示:

①阴极的电极反应式为______________________;
②当有4.14gPb生成时,通过质子交换膜的n(H+)=______________________。
(4)PbI2可用于人工降雨。取一定量的PbI2固体,用蒸馏水配制成t℃饱和溶液,准确移取25.00 mL PbI2饱和溶液分次加入阳离子交换树脂RH+(发生反应:2RH++PbI2 =R2Pb+2H++2I-),用250ml洁净的锥形瓶接收流出液,后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并盛放到锥形瓶中(如图3)。加入酚酞指示剂,用0.0050mol·L-1NaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液10.00mL。可计算出t℃时Ksp(PbI2)为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1L 0.1mol·L1 CH3COOH溶液中加入0.1mol CH3COONa固体,平衡后则溶液中![]() _______(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:_______________
_______(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度间的一个等式:_______________
(2)常温下向20mL 0.1mol·L1 Na2CO3溶液中逐滴加入0.1mol·L1 HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
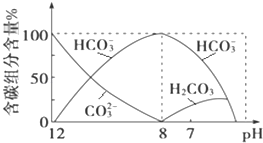
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有__________、________,溶液中含量最多的三种微粒的物质的量浓度的大小关系为_________;
③已知在25℃时,CO32-水解反应的平衡常数Kh═2×104mol·L1,当溶液中c(HCO3-):c(CO32-)=2∶1时,溶液的pH=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com