
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置关系如图所示。下列判断正确的是
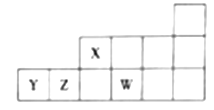
A. 原子半径:rW>rZ>rY>rX
B. 最高价氧化物对应水化物的酸性:Z>X>Y
C. X、Z、W形成的简单氢化物中X的氢化物沸点最高
D. W与Y元素形成的化合物在水溶液中能稳定存在
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 次氯酸钙溶液中通入过量的二氧化碳 Ca2++2ClO﹣+H2O+CO2═CaCO3↓+2HClO
B. Ba(HCO3)2溶液与少量的NaOH溶液反应:Ba2++HCO![]() +OH-==BaCO3↓+H2O
+OH-==BaCO3↓+H2O
C. 用氨水吸收少量二氧化硫 OH﹣+SO2═HSO3﹣
D. 硫酸与氢氧化钡溶液反应:Ba2++SO42-==BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧的脱硝反应为:2NO2(g) + O3(g)![]() N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )
N2O5(g) + O2(g),一定条件下,向2.0L恒容密闭容器中充入2.0molNO2和1.0 molO3,一段时间后达到平衡。下图曲线a表示该反应在温度T下O3的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时O3的浓度随时间的变化。下列叙述正确的是( )
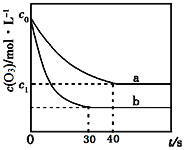
A. 反应2NO2(g) + O3(g)![]() N2O5(g) + O2(g) △S<0
N2O5(g) + O2(g) △S<0
B. 曲线b对应的条件改变可能是加入了催化剂,平衡常数Ka=Kb
C. 曲线b对应的条件改变可能是密闭容器的体积变为4.0L
D. 若c1=0.3mol·L-1,从反应开始到平衡时该反应的速率v(NO2)=0.005 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学结合所学知识探究Na2O2与H2能否反应,设计装置如下,下列说法正确的是( )
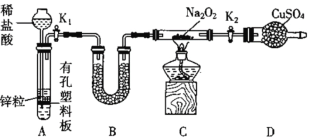
A.若D中无水硫酸铜变蓝,则说明Na2O2与H2反应生成水
B.装置B中盛放浓硫酸,目的是除去A中挥发出来的少量水蒸气
C.装置C加热前,用试管在干燥管管口处收集气体点燃,通过声音判断气体纯度
D.装置A也可直接用于二氧化锰与浓盐酸反应制取氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下:
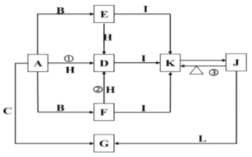
请按要求书写:
(1)反应①的离子方程式: ___________;
(2)物质K与物质L等物质的量离子方程式:___________;
(3)物质G向物质J转化的化学方程式:_______________;
(4)物质C与过量铁粉的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸盐在能源,环保等方面有着广泛的用途。高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为_________________;若维持电流强度为lA,电池工作10 min,理论消耗Zn______g(己知F=965OOC/mol,计算结果小数点后保留一位数字)。
(2)盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”,下同)池移动;若用阳离子交换膜代替盐桥,则钾离子向______移动。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线.由此可得出高铁电地的优点有______________。

Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力.降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(4)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。
(5)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:
H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。

(6)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的______腐蚀。利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。
若X为锌,开关K置于M处,该电化学防护法称为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为98%的浓硫酸(ρ=1.84g·cm-3)配制240mL1.84mol·L-1的稀硫酸。下列叙述正确的是
A. 要用到的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管和容量瓶
B. 量取浓硫酸的体积为24 mL
C. 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,不断搅拌并冷却至室温
D. 先在容量瓶中加入适量水,将量好的浓硫酸注入容量瓶,加水定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室制取漂白粉,并探究氯气与石灰乳反应的条件和产物。
已知:①二氧化锰与浓盐酸反应可制备氯气,同时生成MnCl2;
②氯气和碱的反应为放热反应。温度较高时,氯气和碱还能发生如下反应:3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O
5NaCl+NaClO3+3H2O
该兴趣小组设计了下列实验装置,进行实验。
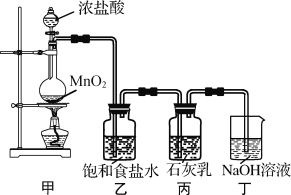
请回答下列问题:
(1)①甲装置用于制备氯气,乙装置的作用是____。
②实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法不正确的是___。(填字母)
A.若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
B.若产物为NaClO、NaCl,则吸收后的溶液中n(NaClO)=n(NaCl)
C.若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
(2)小组成员发现,产物中Ca(ClO)2的质量明显小于理论值。他们讨论后认为,其可能原因是部分氯气未与石灰乳反应而逸出,以及温度升高。为了探究反应条件对产物的影响,他们另取一定量的石灰乳,缓慢匀速地通入足量氯气,得出了Ca(ClO)2、Ca(ClO3)2两种物质的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
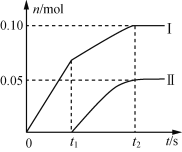
①图中曲线II表示___(填物质的化学式)的物质的量随反应时间变化的关系;
②所取石灰乳中含有Ca(OH)2的物质的量为___mol;
(3)为了提高Ca(ClO)2的产率,可对丙装置作适当改进。请你给出一种改进方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛酸(![]() )是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是

A. 若有2 mol H+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为2 mol
B. M电极上的电极反应式为:2Cl 2e =Cl2↑
C. 电解一段时间后,N极附近溶液的pH变大
D. M极与电源的负极相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com