
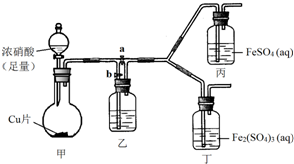
 某学生欲通过实验方法验证Fe2+的性质.
某学生欲通过实验方法验证Fe2+的性质.| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新制FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO${\;}_{3}^{-}$+2H+=Fe3++NO2↑+H2O |
分析 (1)氧化还原反应中,化合价升高的元素具有还原性,根据离子方程式Fe2++NO3-+2H+=Fe3++NO2+H2O可知,Fe2+显示还原性;
(2)Fe3+遇KSCN溶液显血红色;
(3)I、打开活塞a,关闭b时,反应生成的NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象;
II、打开活塞b、关闭a,乙中需盛装水溶液,使NO2与水反应生成NO;
III、为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同,即NO通入FeSO4溶液后显深棕色,而通入Fe2(SO4)3溶液中无现象.
①铜被浓硝酸氧化为Cu(NO3)2,浓硝酸被还原为NO2,据此写出化学方程式;
②装置乙装有的液体是水,使生成的二氧化氮发生反应3NO2+H2O=2HNO3+NO;
③乙的右侧装置中有残留的NO2;
④根据I和III的实验现象分析;
(4)实验I是NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象,据此分析.
解答 解:(1)亚铁离子与浓硝酸发生氧化还原反应,亚铁离子被氧化为铁离子,溶液变为黄色,同时硝酸被还原为二氧化氮,离子方程式为Fe2++NO3-+2H+=Fe3++NO2+H2O中,Fe2+被氧化为Fe3+,化合价升高,显示还原性,
故答案为:还原;
(2)向原新制FeSO4溶液中和反应后溶液中均加入KSCN溶液,前者不变红色,后者变红,而由于Fe3+遇KSCN溶液显血红色,故可以说明滴入的硝酸将Fe2+氧化为了Fe3+,
故答案为:Fe2+被硝酸氧化为Fe3+;
(3)I、打开活塞a,关闭b时,反应生成的NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象;
II、打开活塞b、关闭a,乙中需盛装水溶液,使NO2与水反应生成NO:3NO2+H2O=2HNO3+NO;
III、为与Ⅰ中实验进行对照,更换丙,丁后,使甲中反应继续,观察到的现象与步骤Ⅰ中相同,即NO通入FeSO4溶液后显深棕色,而通入Fe2(SO4)3溶液中无现象.
①铜被浓硝酸氧化为Cu(NO3)2,浓硝酸被还原为NO2,根据得失电子数守恒可知化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+NO2↑+2H2O;
②装置乙装有的液体是水,作用是通过反应3NO2+H2O=2HNO3+NO,使NO2转化为NO,来验证NO与溶液中Fe 2+或Fe 3+发生的反应,
故答案为:使NO2转化为NO;
③装置乙有残留的NO2,所以需要反应一段时间后,利用生成的NO来排出装置中的NO2,从而可以获得纯净的NO,
故答案为:排出乙右侧装置中残留的NO2;
④根据实验I和III的现象可知,溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到)
故答案为:溶液的深棕色是由NO或NO2与Fe2+作用得到(或不是由NO或NO2与Fe3+作用得到);
(4)由于实验I的现象是NO2气体通入了FeSO4溶液中后显深棕色,而通入Fe2(SO4)3溶液中无现象,故可以向盛有浓硝酸的试管中滴入数滴新制的FeSO4溶液,震荡,浓硝酸被还原为NO2,Fe2+被氧化为Fe3+,此时溶液应该无明显的颜色变化,
故答案为:向盛有浓硝酸的试管中滴入数滴新制FeSO4溶液,振荡.
点评 本题考查了Fe2+的还原性以及NO、NO2与Fe2+的反应,Fe2+的还原性和Fe3+的性质一直是高频考点,应加强把握,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | X的化学式为AgS | B. | 银针验毒时,空气中氧气失去电子 | ||
| C. | 反应的还原剂是H2S | D. | 每生成1mo1X转移2mo1电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置为铁的析氢腐蚀,若将铁换成铜,则甲装置就是铜的吸氧腐蚀 | |
| B. | 若将甲装置中的电流表改为电源,无论电源怎么连接,C电极上都会有气体放出 | |
| C. | 乙装置中K关闭后,a极附近颜色逐渐加深变黑 | |
| D. | 若将乙装置中的NaOH溶液换为HCl溶液,则K关闭后b极颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 实验目的 | 实验操作 | |
| A | 鉴别Al3+和Fe3+ | 分别加入少量NaOH溶液 |
| B | 比较Fe和Cu的金属活动性 | 分别加入浓硝酸 |
| C | 证明品红溶液褪色的原因是通入了SO2 | 将褪色后的溶液再加热 |
| D | 分离乙酸乙酯和乙酸 | 加饱和NaOH溶液,蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
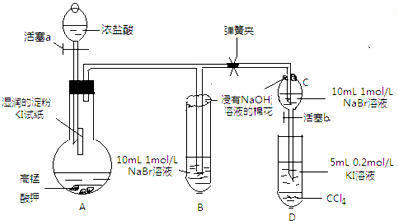 某研究性学习小组进行如下探究活动:
某研究性学习小组进行如下探究活动:| 水 | 四氯化碳 | |
| 溴 | 黄→棕 | 橙→橙红 |
| 碘 | 深黄→褐 | 紫→深紫 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C、13C和14C互为同位素,他们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| B. | 合成纤维是利用自然界的纤维材料通过化学合成方法得到的 | |
| C. | 研制出性能优良的催化剂可以使反应的温度降低,从而起到很好的节能效果 | |
| D. | 碰撞理论和过度态理论是常用的化学反应速率理论,其中过渡态理论可解释温度、浓度等对化学反应速率的影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com