
【题目】有下列几种反应类型: ①消去 ②取代 ③氧化④加成 ⑤还原 ⑥水解,用丙醛制取 1,2﹣丙二醇 (![]() ),按正确的合成路线依次发生的反应所属类型不可能是( )
),按正确的合成路线依次发生的反应所属类型不可能是( )
A. ⑤①④⑥ B. ④①④② C. ⑤①④② D. ⑤③⑥①
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被 (填“ 氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为 。
(2)装置2中的石墨是 极(填“正”或“负”),该装置发生的总反应的离子方程式为 。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
①电源的M端为 极;甲烧杯中铁电极的电极反应为 。
②乙烧杯中电解反应的离子方程式为 。
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是火力发电厂释放出的主要尾气,为减少对环境造成的影响,发电厂试图采用以下方法将其资源化利用,重新获得燃料或重要工业产品。
(1)CO与Cl2在催化剂的作用下合成光气(COCl2)。某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)![]() COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:
COCl2(g) ΔH =a kJ/mol反应过程中测定的部分数据如下表:

①反应0~2min末的平均速率v(COCl2)=_______mol/(L·min)。
②在2min~4min间,v(Cl2)正______v(Cl2)逆 (填“>”、“=”或“<”), 该温度下K =_______L/ mol。
③已知X、L可分别代表温度或压强,如图表示L一定时,CO的转化率随X的变化关系。
X代表的物理量是__________;a_________0 (填“>”,“=”,“<”)。

(2)在催化剂作用下NO和CO转化为无毒气体:
2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
2CO2(g)+N2(g) ΔH=-748 kJ·mol-1
①一定条件下,单位时间内不同温度下测定的NO转化率如图1所示。温度高于710K时,随温度的升高NO转化率降低的原因可能是____________________。
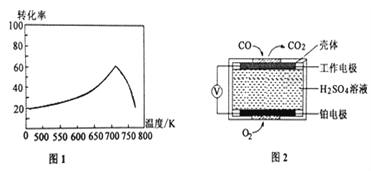
②已知:测定空气中NO和CO含量常用的方法有两种,方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为________________;方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式______________________。
(3)一定条件下,将CO和H2充入2L密闭容器中反应,可生成甲醚(CH3OCH3)。
4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) △H<0
CH3OCH3(g)+H2O(g) △H<0
下列能判断反应达到平衡的是_______________。
A.υ(H2)=2υ(CO) B.容器内的压强不变
C.混合气体的密度不变 D.混合气体的平均相对分子质量不变
E.甲醚的浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y均为元素周期表ⅦA族中的两种元素。下列叙述中,能够说明X的原子得电子能力比Y强的是
A. 原子的电子层数:X>Y
B. 对应的简单离子的还原性:X>Y
C. 气态氢化物的稳定性:X>Y
D. 氧化物对应水化物的酸性:X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸的叙述正确的是( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸在常温下能够使铁、铝等金属钝化
D. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有10mLlmol/LNH4Al(SO4)2溶液的烧杯中滴加1mol/LNaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下。下列有关说法正确的是

A. 当加入50mLNaOH时,溶液中的溶质为NaAlO2
B. m点反应的离子方程式:NH4++OH-=NH3·H2O
C. NH4Al(SO4)2溶液中离子浓度由大到小的顺序是:c(SO42-)>c(Al3+)>c(NH4+)>c(H+)>c(OH-)
D. 若向NH4Al(SO4)2溶液改加20mL1.2mol/LBa(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.02mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A有如图所示的转化关系:

已知:①有机物B是芳香烃的含氧衍生物,其相对分子质量为108,B中氧的质量分数为14.8%;
②![]() ;
;
③G分子式是C18H16O4 ,结构中含有3个六元环。
根据以上信息,回答下列问题:
(1)有机物E中含氧官能团名称是_____________。
(2)A的结构简式为_____________。
(3)条件Ⅲ为_____________;E→H、D→F的反应类型分别为_____________、_____________。
(4)Q是N的同系物,相对分子质量比N大14,Q有多种同分异构体,则同时符合下列条件的同分异构体有_____________种,其中核磁共振氢谱为4组峰,且峰面积之比为3:2:2:1的有机物结构简式为_____________。
a.含有苯环 b.能发生银镜反应 c.遇FeCl3溶液不显紫色 d.不考虑醚键
(5)写出下列转化的化学方程式:
B→M__________________________
F→G__________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com