解:(1)在水溶液里或熔融状态下能导电的化合物是电解质,③CaO、⑤H
2SO
4、⑥Ba(OH)
2、⑩Al
2(SO
4)
3是电解质;⑧氨水、⑨稀硝酸、⑦红褐色的氢氧化铁液体是混合物,不是电解质也不是非电解质;④CO
2 是非电解质;
①H
2、②铝既不是电解质也不是非电解质.⑦红褐色的氢氧化铁液体是胶体能产生丁达尔效应.
故答案为:③⑤⑥⑩;丁达尔.
(2)H
++OH
-═H
2O表示强酸和强碱的酸碱中和反应,且酸碱反应中只有水生成,强酸是硝酸,强碱是氢氧化钡,反应方程式为Ba(OH)
2+2HNO
3=Ba(NO
3)
2+2H
2O;少量二氧化碳和氢氧化钡反应生成碳酸钡和水,离子方程式为
Ba
2++2OH
-+CO
2=BaCO
3↓+H
2O.
故答案为:Ba(OH)
2+2HNO
3=Ba(NO
3)
2+2H
2O;Ba
2++2OH
-+CO
2=BaCO
3↓+H
2O.
(3)17.1gAl
2(SO
4)
3的物质的量是
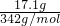
=0.05mol,所以硫酸根离子的个数=0.05mol×3N
A=0.15N
A;
C=
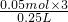
=0.6mol/L.
故答案为:0.15N
A;0.6mol/L.
(4)强电解质写化学式,气体、弱电解质、金属单质写化学式,
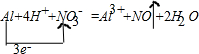
;
设转移电子的物质的量是x,被还原的硝酸根的物质的量是y.
Al+4H
++NO
3-=Al
3++NO↑+2H
2O转移电子
1mol 22.4L 3mol
y 4.48L x
所以x=0.6mol
y=0.2mol,被还原的硝酸根的物质的量等于被还原的硝酸的物质的量为0.2mol,所以被还原的硝酸的质量=0.2mol×63g/mol=12.6g,
故答案为:

;0.6mol;12.6g.
分析:(1)在水溶液里或熔融状态下能导电的化合物是电解质,胶体能产生丁达尔效应.
(2)H
++OH
-═H
2O表示强酸和强碱的酸碱中和反应;少量二氧化碳和氢氧化钡反应生成碳酸钡和水.
(3)先计算硫酸铝的物质的量,根据化学式中硫酸铝和硫酸根离子的关系式计算硫酸根离子的个数,根据物质的量浓度公式计算硫酸根离子的物质的量浓度.
(4)根据一氧化氮和转移电子之间的关系式计算转移电子的物质的量,根据一氧化氮和被还原硝酸的关系式计算被还原硝酸的质量.
点评:本题考查了电解质的判断、离子方程式的书写、物质的量的有关计算,难度不大,注意硝酸和铝的反应中只有部分硝酸被还原,部分起酸的作用.

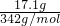 =0.05mol,所以硫酸根离子的个数=0.05mol×3NA=0.15NA;
=0.05mol,所以硫酸根离子的个数=0.05mol×3NA=0.15NA;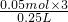 =0.6mol/L.
=0.6mol/L.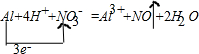 ;
; ;0.6mol;12.6g.
;0.6mol;12.6g.
