
8NH3和NO2在催化剂作用下反应:8NH3+6NO2===7N2+12H2O。若还原产物比氧化产物少0.1 mol,则下列判断正确的是( )
A.转移电子2.4NA个
B.生成气体的体积42.56 L(标准状况)
C.还原剂比氧化剂多0.2 mol
D.被还原的氮原子是11.2 g
科目:高中化学 来源: 题型:
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上,通过如下转化可制得KClO3晶体:
NaCl溶液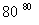 NaClO3溶液
NaClO3溶液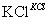 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式:NaCl+H2O===NaClO3+__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO3晶体而无其他晶体析出的原因是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO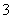 ===Cu2++NO↑+2H2O
===Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2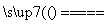 CuCl+HCl
CuCl+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH________7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
①甲同学认为步骤Ⅰ中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________________________________________________________________________。
②乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
 Fe3++
Fe3++ SO
SO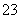 +
+ ________——
________—— Fe2++
Fe2++ ________+
________+ ________
________
 乙同学查阅资料得知:
乙同学查阅资料得知:
ⅰ.Fe2+与 反应生成墨绿色的絮状沉淀FeSO3;
反应生成墨绿色的絮状沉淀FeSO3;
ⅱ.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤Ⅰ中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________________________________________________________________________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol·L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
①经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是________(填字母)。
a.K3[Fe(CN)6]溶液
b.KSCN溶液
c.KMnO4溶液
②已知H2SO3是弱酸,请结合电离方程式说明步骤Ⅲ中出现红褐色的原因:________________________________________________________________________。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl-四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体。

(1)沉淀1中含有的金属单质是__________。
(2)氧化时加入H2O2溶液发生反应的离子方程式为
________________________________________________________________________。
(3)下列物质中,可以作为试剂X的是__________(填字母)。
A.BaCl2 B.BaCO3
C.NaOH D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是__________。
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是__________。
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为__________、冷却结晶、__________、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量 121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为( )
A.920 kJ B.557 kJ
C.436 kJ D.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与金属腐蚀有关的说法,正确的是( )


A.图1中,铁钉易被腐蚀
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com