
分析 温度为298K,压力为101.325kpa为标准状况下,根据n=$\frac{V}{{V}_{m}}$计算出该气体的物质的量,最高价M=$\frac{m}{n}$计算出其摩尔质量,从而可知该气体的相对分子质量.
解答 解:298K、101.325kpa为标准状况下,0.6L该气体的物质的量为:n=$\frac{0.6L}{22.4L/mol}$=$\frac{3}{112}$mol,
该气体的摩尔质量为:M=$\frac{1.08g}{\frac{3}{112}mol}$≈40g/mol,该气体的相对分子质量为40,
答:该气体的相对分子质量为40.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积之间的关系即可解答,注意掌握相对分子质量与摩尔质量之间的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
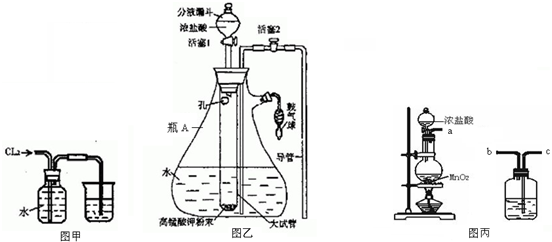
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g•mol-1 | B. | 16 g•mol-1 | C. | 32 | D. | 64 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质 | |
| B. | Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐 | |
| C. | 二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应 | |
| D. | 氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再通入少量氯气,$\frac{c({H}^{+})}{c(Cl{O}^{-})}$减小 | |
| B. | 通入少量SO2,溶液漂白性增强 | |
| C. | 加入少量的硫酸钠固体,pH增大,溶液漂白性增强 | |
| D. | 光照过程中,有气泡冒出,溶液的导电性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
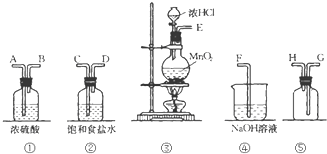 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 种 | B. | 6 种 | C. | 5 种 | D. | 4 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,消耗1molSO2的同时消耗1molSO3 | |
| C. | 如果反应前充入由18O原子组成的O2,反应达到平衡状态时,18O在所有物质中都存在 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com