
| A. | 若M与W组成原子数为1:1、1:2型离子化合物,则W2G的水溶液含7种粒子 | |
| B. | 若W单质在QM2气体中燃烧生成黑色、白色两种固体,则W的原子序数与族序数之比为5 | |
| C. | 若W与G组成的化合物在水中剧烈反应,产生白色沉淀和气体,M与W组成的化合物易升华 | |
| D. | 若M与W组成的化合物作光导纤维材料,则W单质及其氧化物都抗所有酸溶液的腐蚀 |
分析 现有Q、M、W、G四种原子依次增大的短周期元素,Q与M组成两种常见的气态化合物,其中一种是温室气体,另一种是强还原剂,则Q为C元素、M为O元素;M与G为与同主族,则G为S元素.
A.若M(O元素)与W组成原子数为1:1、1:2型离子化合物,则W为Na,则Na2S的水溶液硫离子发生水解;
B.若W单质在CO2气体中燃烧生成黑色、白色两种固体,则W为Mg;
C.若W与G组成的化合物在水中剧烈反应,产生白色沉淀和气体,则W为Al;
D.若M与W组成的化合物作光导纤维材料,则W为Si,Si与二氧化硅均能与氢氟酸反应.
解答 解:现有Q、M、W、G四种原子依次增大的短周期元素,Q与M组成两种常见的气态化合物,其中一种是温室气体,另一种是强还原剂,则Q为C元素、M为O元素;M与G为与同主族,则G为S元素.
A.若M(O元素)与W组成原子数为1:1、1:2型离子化合物,则W为Na,则Na2S的水溶液硫离子发生水解,含有粒子有:H2S、H2O、Na+、S2-、OH-、H+、HS-,故A正确;
B.若W单质在CO2气体中燃烧生成黑色、白色两种固体,则W为Mg,Mg原子序数与族序数之比为10,故B错误;
C.若W与G组成的化合物在水中剧烈反应,产生白色沉淀和气体,则W为Al,与M组成的化合物为氧化铝,熔点很高,不易升华,故C错误;
D.若M与W组成的化合物作光导纤维材料,则W为Si,Si与二氧化硅均能与氢氟酸反应,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对元素化合物性质的考查,难度中等,注意B、C选项,在推断题目中会经常涉及.


科目:高中化学 来源: 题型:多选题
| A. | 氮的氧化物可引起光化学烟雾 | |
| B. | 为防止粮食、罐头、水果等食品腐烂,常用氮气做保护气 | |
| C. | SO2可以用作食物和干果的防腐剂 | |
| D. | 铵盐受热易分解,生成氨气和对应的酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO在平衡时转化率为10% | |
| B. | 平衡浓度c(CO2)=c(H2) | |
| C. | 其他条件不变时,缩小体积,反应②平衡不移动 | |
| D. | 平衡时增大碳的质量,反应①中热量值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率主要取决于②的快慢 | B. | NOBr2是该反应的催化剂 | ||
| C. | 该反应的焓变等于akJ•mol-1 | D. | 反应速率:v(NO)=v(NOBr)=2v(Br2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
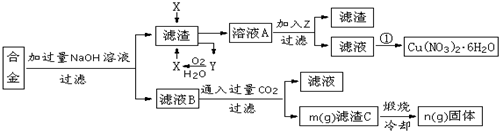
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径:r(Z)>r(X)>r(Y)>r(W) | |
| B. | X、Y、Z、W形成的单质最多有6种 | |
| C. | 四种元素均可与氢元素形成18电子分子 | |
| D. | 四种元素中.Z的最高价氧化物对应水化物酸化最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制容器可长期盛放酸性或碱性物质 | |
| B. | 甲烷会导致某些温泉有臭鸡蛋气味 | |
| C. | 太阳能的开发利用可降低碳排放量 | |
| D. | 塑料垃圾会造成水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
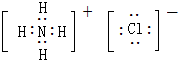 ,Y的最简单氢化物分子呈三角锥型;
,Y的最简单氢化物分子呈三角锥型;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com