
| A. | H2的生成速率与I2的生成速率相等 | |
| B. | 若单位时间内生成n mol H2的同时生成2n mol HI | |
| C. | H2、I2、HI的浓度相等 | |
| D. | 反应容器内的压强不随时间的变化而变化 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、H2的生成速率与I2的生成速率始终相等,与反应是否达到平衡无关,故A错误;
B、若单位时间内生成n mol H2的同时生成2n mol HI,表明v(正)=v(逆),反应达到平衡,故B正确;
C、当体系达到平衡时,H2、I2、HI的浓度保持不变,但不一定相等,故C错误;
D、该反应为气体总体积不变的反应,气体总压强始终保持不变,与反应是否达到平衡状态无关,故D错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


科目:高中化学 来源: 题型:选择题
| A. | 32 g | B. | 32 g/mol | C. | 34 g | D. | 34 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
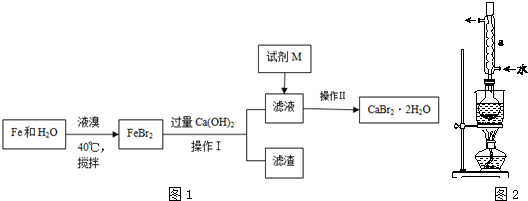
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2或SO2都会导致酸雨的形成 | |
| B. | 苯与溴水在铁催化下可发生取代反应 | |
| C. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| D. | 电解水生成H2和O2的实验中,可加入少量盐酸增强导电性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.8×10-3mol | B. | 4.4×10-3mol | C. | 3.2×10-3mol | D. | 2.2×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼过程中的尾气可用来制硫酸 | |
| B. | 上述过程中,由1molCuFeS2制取1molCu时共消耗2molO2 | |
| C. | 在反应2Cu2O+Cu2S═6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1mol电子时,阳极溶解铜的质量为32g |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
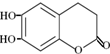 具有抗菌作用.下列关于七树内酯的叙述正确的是( )
具有抗菌作用.下列关于七树内酯的叙述正确的是( )| A. | 七叶树内酯的分子式为C9H6O4 | B. | 可看成酚类又可看成酯类化合物 | ||
| C. | 能与银氨溶液发生银镜反应 | D. | 最多能与3mol Br2发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com