
����Ŀ����.��֪ij���淴Ӧ��aA(g)��bB(g) ![]() cC(g)��dD(g)����ش��������⣺
cC(g)��dD(g)����ش��������⣺

(1)����ʵ��ⶨ����������˸÷�Ӧ�ﵽƽ��״̬ʱ���ı����������Ӧ������ʱ��Ĺ�ϵͼ��(��ͼ1��ʾ)�����������D�����ı仯������ͼ���е�______�Σ�����ñ仯���̵����������_________________________________________��
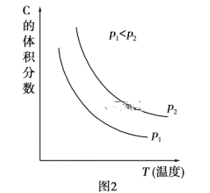
(2)����ʵ��ⶨ���������ͼ2���ɴ�ͼ����Եó��������¶ȣ�����ƽ�⽫��____(��������Ӧ�������淴Ӧ��)�����ƶ�����Ӧ������֮��Ĺ�ϵ��a��b______c��d(��������������С��������������������ȷ����)��
��.��ҵ�ϳɰ���Ӧ���£�N2��3H2![]() 2NH3����ش��������⣺
2NH3����ش��������⣺
(1)��һ��������2L���ܱ������н���ʵ�飬������������ݣ�
���� | N2 | H2 | NH3 |
��ʼ(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
ƽ��ʱ(mol) | 2 |
��10s�ڣ���������ʾ�Ļ�ѧ��Ӧ������______���÷�Ӧ�Ļ�ѧƽ�ⳣ����________��
(2)���ݻ��������ɷֵ��������ʣ�����Ϊ��ҵ�Ͻ������ӻ�������з�������Ĵ�ʩ��________���Ӷ��ﵽ��Ӧ����ѭ�����õ�Ŀ�ġ�ʵ���Ҽ��鰱���ķ�����__________��
���𰸡�t3��t4 ���ӷ�Ӧ���Ũ�Ȼ�����AŨ�Ȼ�����BŨ�� �淴Ӧ ���� 0.12mol/(L��s) 0.25 ����ʹNH3��ΪҺ�壬��N2��H2���뿪 ��ʪ��ĺ�ɫʯ����ֽ����ƿ�ڻ��Թܿڣ�����ֽ����ɫ��˵�����ڰ���
��������
I.��1��t3ʱ�̸ı��������ֻ��������Ӧ���ʣ��淴Ӧ���ʲ��䣬�����ӷ�Ӧ���Ũ�ȣ���Ӧ������Ӧ������У���D�����ʵ�������t5ʱ�̣���Ӧ���淴Ӧ������У�����D�����������D�����ı仯������ͼ���е�t3��t4��
��2������ͼ��2�������¶ȵ����ߣ�C�����������С��˵��ƽ�����淴Ӧ������У�������������ԭ�����÷�Ӧ������Ӧ�����Ƿ��ȷ�Ӧ����H<0�������£�ѹǿ����C�����������������ѹǿ��ƽ��������Ӧ������У�a��b>c��d��
II.��1��10s�ڣ�����NH3�����ʵ���Ϊ1.6mol����ʱ����H2�����ʵ���Ϊ![]() =2.4mol�����ݻ�ѧ��Ӧ������ѧ����ʽ��v(H2)=
=2.4mol�����ݻ�ѧ��Ӧ������ѧ����ʽ��v(H2)=![]() =0.12mol/(L��s)���ﵽƽ��ʱ��n(NH3)=2mol��n(H2)=4mol��n(N2)=1mol������ƽ�ⳣ���ı���ʽ��K=
=0.12mol/(L��s)���ﵽƽ��ʱ��n(NH3)=2mol��n(H2)=4mol��n(N2)=1mol������ƽ�ⳣ���ı���ʽ��K= =0.25��
=0.25��
��2��NH3��Һ�������Բ��ý���ʹNH3��ΪҺ�壬��N2��H2���뿪��NH3����ѧ��ѧ����Ψһһ�ּ������壬����ʱ���Բ�����ʪ��ĺ�ɫʯ����ֽ����ƿ�ڻ��Թܿڣ�����ֽ����ɫ��˵�����ڰ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ϣ������������ȷ���ǣ� ��
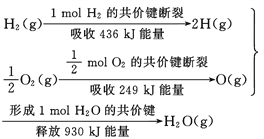
A. 2 mol H2(g)�� 1 mol O2(g)��Ӧ���� 2 mol H2O(g)��������Ϊ490 kJ
B. ��ѧ��Ӧ�������仯�Ĵ�С�뷴Ӧ�������������
C. 1 mol H2(g) ��0.5mol O2(g) ��Ӧ���� 1 mol H2O(l)�ͷ�����Ϊ245 kJ
D. 2molH2O (g)��������2 mol H2(g)��1 mol O2(g)������֮�͵�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ȡ0.1mol/L��NaA��NaB��������Һ��1L���ֱ�ͨ��0.02molCO2���������·�Ӧ��NaA+CO2+H2O=HA+NaHCO3��2NaB+CO2+H2O=2HB+Na2CO3����1LHA��HB����Һ�ֱ��ˮϡ�������ΪVLʱ��������ͼ���ߣ�������˵����ȷ���ǣ� ��
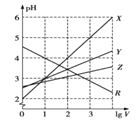
A.X��HA��Y��HB
B.������pH��NaA��Һ>NaB��Һ
C.�������£�Ũ�Ⱦ�Ϊ0.1mol/L��NaA��HA�Ļ����ҺpH>7����c(A-)>c(HA)
D.�ڵ�Ũ�ȵ�NaA��NaB�����Һ��ͨ��HCl������ʱ��c(Cl-)=c(HA)+c(HB)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵����ȷ���ǣ� ��
A.��״���£�22.4LCCl4�к�ԭ������Ϊ5NA
B.���ʵ���Ũ��Ϊ0.5![]() MgCl2��Һ�У�����Cl����ĿΪNA
MgCl2��Һ�У�����Cl����ĿΪNA
C.���³�ѹ�£�NA��CO2����ռ���������22.4L
D.3.2g�������ͳ�����ɵĻ�����к����������ӵ���ĿΪ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���10 mL 0.10molL1-1YOH��Һ���μ�0.20molL-1HX ��Һ�������Һ��pH �仯��ͼ��ʾ(�¶Ⱥ�����仯���Ѳ���)�����н��۴������
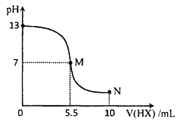
A.HXΪһԪ���ᣬYOH ΪһԪǿ��
B.M���Ӧ��Һ��ˮ�ĵ���̶ȴ���N ����Һ��ˮ�ĵ���̶�
C.N���Ӧ��Һ������Ũ�ȣ�c(HX)> c(X - ) > c(Y+ ) > c(H+ ) > c(OH-)
D.����ʱ,pH = a ��YX��Һ��ˮ�������c(OH-)=l.0��10-(14-a)molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SO2�ĺ����Ǻ���������Ⱦ��һ����Ҫָ�ꡣ��ҵ�ϳ����ô���ԭ�������շ����ⷨ����SO2�����ô���ԭ SO2�� ����������SO2��Ⱦ�����ҿɵõ��о��ü�ֵ�ĵ���S��
(1)��֪CH4��S��ȼ����(��H)�ֱ�Ϊ-890.3 kJ/ mol��һ297.2 kJ/ mol , ��CH4 ����ԭSO2��Ӧ��CH4(g) +2 SO2 (g) =CO2(g)+ 2S(s)+ 2 H2O(1) ��H =_____kJ/mol
(2)�ں����ܱ������У��� H2��ԭSO2����S �ķ�Ӧ���������(��ͼ1��ʾ)���ù�����������ʵ����ʵ���Ũ����ʱ��ı仯��ϵ��ͼ2��ʾ ��

������֪XΪ_______(�ѧʽ)��o~t1ʱ��ε��¶�Ϊ_______��o~ t1ʱ�����SO2��ʾ�Ļ�ѧ��Ӧ����Ϊ______________��
(3)��̿����ԭSO2����S2, ��ѧ����ʽΪ2C(s)+ 2 SO2 (g)![]() S2(g)+2CO2(g)��H < 0��
S2(g)+2CO2(g)��H < 0��
ʵ���ã�v��= k ��c2 (SO2 ) , v��= k ��c(S2 ) c2 ( CO 2) ( k����k��Ϊ���ʳ�����ֻ���¶��й�)��ij�¶��£���2L�ĺ����ܱ������г���lmol SO2��������������̿������Ӧ��ƽ��ʱ��SO2 ת����Ϊ80%,��
��k����k ��=_______________��
���������¶ȣ�k������ı���______( �> ������< ����= ��) k ������ı�����
(4) ������ͼ��ʾװ��(�缫��Ϊ���Ե缫)������SO2��

ֱ����ԴaΪ_______�������ʱ���缫B�ĵ缫��ӦʽΪ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.����8�ֻ�ѧ���ţ�![]() O2��
O2��![]() O3��
O3��![]() H��
H��![]() C��
C��![]() Na��
Na��![]() N��
N��![]() C��
C��![]() Mg��
Mg��
��1����ʾ���صķ��Ź�_____�֡�
��2����Ϊͬλ�ص���______����������ȵ���_______����������ȵ���____��
��3��������ͬ��H216O��D216O����������֮��Ϊ________��
��.�������ڱ��Խ��߹�����Be��Al�ĵ��ʼ��仯������������ơ��Իش��������⣺
��4��д��Be��NaOH��Һ��Ӧ����Na2[Be(OH)4]�����ӷ���ʽ____________
��5��Be(OH)2��Mg(OH)2����_________����
��.ͭ��������Ȼͬλ�� ![]() Cu��
Cu��![]() Cu���ο�ͭ�����ԭ��������63.5����
Cu���ο�ͭ�����ԭ��������63.5����
��6������![]() Cu�������ٷֺ���Լ��_________��������3λ��Ч���֣�
Cu�������ٷֺ���Լ��_________��������3λ��Ч���֣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mg-H2O2��ؿ������������˼�ʻ��DZ�������õ���Ժ�ˮΪ�������Һ��ʾ��ͼ���¡��õ�ع���ʱ������˵����ȷ����( )
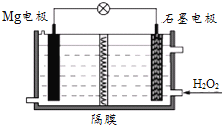
A.Mg�缫�Ǹõ�ص�����
B.��Һ�е�Cl���������ƶ�
C.H2O2��ʯī�缫�Ϸ���������Ӧ
D.ʯī�缫������Һ��pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����ǵ��͵Ŀɳ���أ�����ܷ�ӦʽΪ��Pb��PbO2��2H2SO4 ![]() 2PbSO4��2H2O���ش��������⣺
2PbSO4��2H2O���ش��������⣺
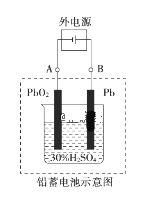
��1���ŵ�ʱ������Ϊ_______�缫����д���õ缫�ĵ缫��Ӧʽ��___________�����Һ��H2SO4��Ũ�Ƚ���____________���������������� �������� ������������
��2����طŵ�ʱ�������·ͨ��0.1 mol����ʱ�������ϸ��������������________g����������ĵ��������ʵ���Ϊ_______mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com