
关于下列图示的说法中,正确的是
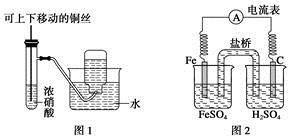
A.图1制备并收集少量NO2气体
B.图2是原电池装置,Fe电极为负极
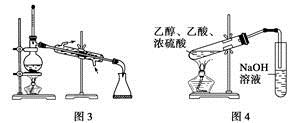
C.图3常用于分离互不相溶的液体
D.图4可用于实验室制取和收集乙酸乙酯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b﹤d。符合上述实验结果的盐溶液是
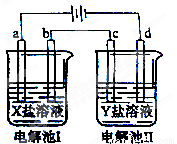
选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
①w=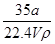 ×100% ②c=
×100% ②c= 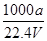
③若上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w④若上述溶液中再加入0.5V mL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为c(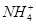 )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
A.①④ B.②③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的检验(解析版) 题型:选择题
某同学用沉淀量测定Na2CO3和NaOH混合物中NaOH的质量分数,有关叙述如下。
①可以使用MgCl2溶液作沉淀剂,使OH-转化为氢氧化镁沉淀
②检验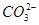 是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
是否完全沉淀的操作方法是向上层清液中继续滴加沉淀剂溶液
③用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是实验结果的准确度较高
④用氯化钡溶液代替氯化钙溶液作沉淀剂,优点是碳酸根离子能完全转化为沉淀。
其中正确的是
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:实验题
一定浓度NaHCO3溶液与CuSO4溶液反应后生成了蓝绿色颗粒状沉淀。就沉淀成分提出了如下三种假设:
假设一:沉淀是CuCO3;假设二:沉淀是Cu(OH)2;
假设三:沉淀是CuCO3和Cu(OH)2的混合物。
(1)写出假设二,沉淀是Cu(OH)2生成的理由 (用离子方程式表示);
(2)为了探究沉淀的成分,取出了一部分沉淀,滴加稀盐酸,有气体放出。凭此现象,判断沉淀中含有 ;
(3)为了进一步探究沉淀的成分,进而确定假设中何种假设成立,设计实验,装置图如下:
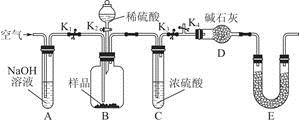
①研究沉淀物组成前,须将沉淀从溶液中分离并净化。具体操作依次为 、洗涤、干燥;
②装置E中药品的名称是 作用为 ;
③实验过程中有以下操作步骤:a.打开K1、K3,关闭K2、K4,通入过量空气。此步骤的作用是 。
b.关闭K1、K3,打开K2、K4,充分反应,c.再通入过量空气时,活塞处于打开的是 ,关闭的是 。
④若沉淀样品的质量为m g,装置D的质量增加了n g;若沉淀样品为纯净物,m、 n之间的关系为 。
若假设三成立,则Cu(OH)2的质量分数为 ;若不进行步骤c,则会使测得结果 (填“偏高”“无影响”“偏低”)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
A.仅有② B.仅有②④ C.仅有②③④ D.全部符合要求
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
已知下列热化学方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)= Fe3O4(s)+CO2(g) ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为
A.-218 kJ/mol B.-109 kJ/mol C.+218 kJ/mol D.+109 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学溶度积、沉淀的生成、溶解、转化(解析版) 题型:选择题
已知298 K时下列物质的溶度积(单位略)。
| CH3COOAg | AgCl | Ag2CrO4 | Ag2S |
Ksp | 2.3×10-3 | 1.77×10-10 | 1.12×10-12 | 6.7×10-15 |
下列说法正确的是
A.等体积、浓度均为0.02 mol·L-1的CH3COONa和AgNO3溶液混合能产生沉淀
B.向含有浓度均为0.01 mol·L-1的 和Cl-的溶液中慢慢滴入AgNO3溶液时,
和Cl-的溶液中慢慢滴入AgNO3溶液时, 先沉淀
先沉淀
C.在CH3COOAg悬浊液中加入盐酸时发生反应的离子方程式为CH3COOAg+H++Cl-=CH3COOH+AgCl
D.298 K时,上述四种饱和溶液的物质的量浓度:
c(CH3COOAg)>c(AgCl)>c(Ag2CrO4)>c(Ag2S)
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氨及铵盐(解析版) 题型:选择题
关于下列各实验装置的叙述中,正确的是

A.装置①制备乙酸乙酯
B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
C.装置③可用于干燥,收集Cl2,并吸收多余的Cl2
D.装置④配制一定物质的量浓度的溶液时转移液体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com