
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层的3倍;元素W基态原子的核外电子共有16种运动状态.分析 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,以此解答该题.
解答 解:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,
(1)①元素Y为Cl,Cl有3个电子层,最外层7个电子,故处于周期表中第三周期第ⅦA族,元素X为Cu,处于周期表中ds区,故答案为:ds; 三;ⅦA;
②O所在周期为第二周期,其中第一电离能最大的元素是氖,故答案为:氖;
③X为Cu,Cu+的核外电子排布式为:1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
④Cl和S两元素所形成的最高价氧化物对应的水化物分别为H2SO4和HClO4,元素的非金属性越强,其最高价氧化物水化物的酸性越强,由于非金属性Cl>S,故酸性较强的是HClO4,故答案为:HClO4;
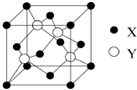
(2)Cu与Cl所形成化合物晶体的晶胞如图所示,1个晶胞中Cu为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cl为:4,故此晶胞中Cu与Cl的个数比为1:1,故化学式为:
故答案为:4; CuCl;
(3)①在乙醇中的溶解度:O的氢化物(H2O)大于H2S,其主要原因是:水分子与乙醇分子间能形成氢键,且水分子和乙醇分子中均有羟基,结构相似,
故答案为:水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基;
②由于O原子的比较小于S原子,故H2O分子内H-O的键能大于H2S分子内H-S的键能,或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长,
故答案为:>;H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长)
点评 本题主要考查的是元素的推断以及元素周期律的应用,为高考常见题型,侧重于学生的分析能力和计算能力的考查,涉及元素位置推断、离子核外电子排布式书写、化学反应方程式书写等,平时学习应注意总结归纳.


科目:高中化学 来源: 题型:解答题
| 实 验 操 作 | 现 象 和 结 论 |
| 步骤一:取萃取后的上层清液滴加2滴K4[Fe(CN)6] | 若产生①蓝色沉淀, 则②猜想一不成立; |
| 步骤二:往探究Ⅲ所得溶液中加入少量乙醚,充分振荡、静置分层 | 若③乙醚层呈血红色, 则④猜想二成立; |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(2n-4m)}{V}mol•{L}^{-1}$ | B. | $\frac{(n-m)}{V}mol•{L}^{-1}$ | C. | $\frac{(2n-2m)}{V}mol•{L}^{-1}$ | D. | $\frac{(5n-10m)}{V}mol•{L}^{-1}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
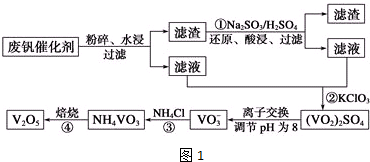
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
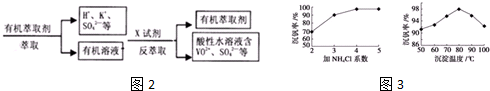
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳纳米管和C60都是单质 | |
| B. | 碳纳米管和金刚石的结构和性质相同 | |
| C. | 碳纳米管和石墨互为同素异形体 | |
| D. | 碳纳米管也能在空气中燃烧生成二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | a中试剂 | b中试剂 | 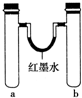 |
| 1 | 0.1g Na、3mL水 | 0.1g Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的熔沸点逐渐升高 | B. | 氢化物的稳定性逐渐增强 | ||
| C. | 单质的氧化性逐渐增强 | D. | 元素的非金属性逐渐增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com