
| A. | 甲烷分子中四个碳氢键键长相等 | |
| B. | 甲烷分子中四个碳氢键键角相等 | |
| C. | 甲烷分子中四个碳氢键键能相等 | |
| D. | 由于甲烷分子三个键参数都分别相等,所以甲烷的空间构型是平面正方形结构 |
分析 甲烷的中心原子是碳原子,碳原子上的价电子都形成了共价键,中心原子价层孤电子对数$\frac{4+1×4}{2}$=4,碳原子sp3杂化,该分子是正四面体结构;甲烷分子中只有C-H键的键能、键长和键角完全相同,据此进行解答.
解答 解:A.甲烷为正四面体结构,四个碳氢键完全相同,则四个碳氢键键长相等,故A正确;
B.甲烷分子为正四面体结构,其分子中四个碳氢键键角相等,故B正确;
C.甲烷分子为正四面体结构,四个碳氢键键能相等,故C正确;
D.甲烷的中心原子是碳原子,碳原子上的价电子都形成了共价键,中心原子价层孤电子对数$\frac{4+1×4}{2}$=4,碳原子sp3杂化,该分子是正四面体结构,故D错误;
故选D.
点评 本题考查有机物结构判断,题目难度不大,明确甲烷分子构型为解答关键,注意掌握常见有机物组成、结构与性质,试题培养了学生的灵活应用能力.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
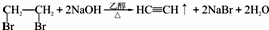 ;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$
;乙炔制得氯乙烯;最后由氯乙烯制得氯乙烯,反应的化学方程式为nCH2=CHCl$\stackrel{一定条件}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b互为同分异构体 | B. | b和c是同系物 | ||
| C. | a和b都能发生加成反应 | D. | 只有b和c能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )| A. | I表示的是滴定醋酸的曲线 | |
| B. | pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL | |
| C. | V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) | |
| D. | V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
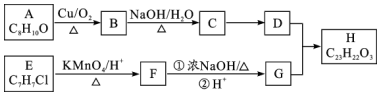
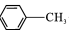 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$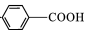
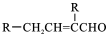
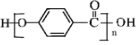
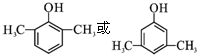
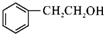 ,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为
,C→D的反应类型为加成反应;B中含氧官能团名称为醛基,F中不含氧的官能团的名称为氯原子; H的结构简式为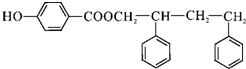 ;
;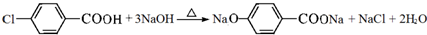 ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:
已知X、Y、Z、M、G是五种短周期主族元素,且原子序数依次增大.X原子核内只有1个质子,Y的原子最外层电子数是其电子层数的2倍,Y与G同主族,Z的一种单质能吸收对人体有害的紫外线,M是地壳中含量最高的金属元素.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com