
 2NH3(g) ΔH<0,下列各项中不能说明该反应已经达到化学平衡状态的是( )
2NH3(g) ΔH<0,下列各项中不能说明该反应已经达到化学平衡状态的是( )| A.体系的压强不再改变 |
| B.体系的温度不再改变 |
| C.断裂1 mol N≡N键的同时,也断裂6 mol N—H键 |
| D.反应消耗的N2、H2与产生的NH3的速率v(N2)∶v(H2)∶v(NH3)=1∶3∶2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
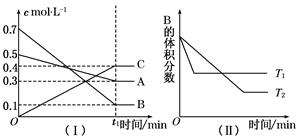
 I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是
I3-(aq);某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法中不正确的是 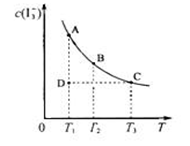
A.反应I2(aq)+I-(aq) I3-(aq)的△H<0 I3-(aq)的△H<0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1﹥K2 |
| C.若反应进行到状态D时,一定有v正﹤v逆 |
| D.状态A与状态B相比,状态B的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 |
| B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强 |
| C.向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为
xC(g),达到平衡后,C的体积分数为ω%;若维持容器的容积和温度不变,按起始物质的量A:0.6mol、B:0.3mol、C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值为| A.只能为2 | B.只能为3 |
| C.可能是2,也可能是3 | D.无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
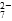 和CrO
和CrO ,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大损害,必须进行处理。常用的处理方法有两种。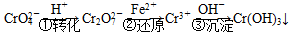
 (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O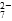 (橙色)+H2O
(橙色)+H2O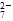 和CrO
和CrO 的浓度相同
的浓度相同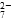 )=v(CrO
)=v(CrO )
)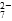 离子,需要______mol的FeSO4·7H2O。
离子,需要______mol的FeSO4·7H2O。 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)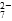 的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。
的酸性废水,随着电解的进行,在阴极附近溶液 pH 升高,产生 Cr(OH)3沉淀。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。| A.在单位时问内生成1mol CO2的同时消耗了lmol CO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |

 CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。 CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:| 实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:
CH3OCH3(g)+H2O(g) ΔH=-25 kJ/mol某温度下的平衡常数为400。此温度下,在1 L的密闭容器中加入CH3OH,反应到某时刻测得各组分的物质的量浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| c/(mol·L-1) | 0.8 | 1.24 | 1.24 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.达到化学平衡时,N2将完全转化为NH3 |
| B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C.达到化学平衡时,正反应和逆反应的速率都为零 |
| D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com