
【题目】实验室常用如图装置所示方法制备氯气:
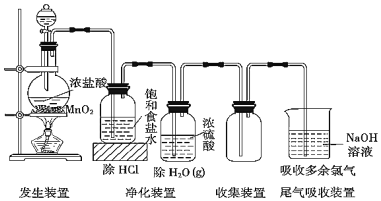
(1)1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是______
(2)实验结束后,取少量尾气吸收装置中所得溶液,滴加硫酸溶液有单质生成,反应的离子方程式是______
【答案】浓盐酸挥发,稀盐酸不反应 Cl-+ClO-+2H+=Cl2↑+H2O
【解析】
发生装置中二氧化锰固体和浓盐酸加热反应生成氯气、二氧化锰和水,通过净化装置中的饱和食盐水除去氯气中的氯化氢气体,通过浓硫酸除去水蒸气,得到干燥纯净的氯气利用向上排气法收集,剩余氯气不能排放需要氢氧化钠溶液吸收。
(1)1mol MnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,可能的原因是:浓盐酸随反应进行变为稀盐酸后不与二氧化锰反应生成氯气,浓盐酸挥发损失;
(2)实验结束后,取少量尾气吸收装置中所得溶液,滴加硫酸溶液有单质生成为氯气,反应的离子方程式:Cl-+ClO-+2H+═Cl2↑+H2O。


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】用200 mL 1 mol/L 氯化铝溶液与一定量 3 mol/L的氢氧化钠溶液混合,可得到氢氧化铝7.8g,请计算需要此氢氧化钠溶液的体积为多少毫升?(写计算步骤)________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】商代炼铜时,所用的矿物原料主要是孔雀石,主要燃料是木炭,在温度1000℃左右冶炼,可能涉及的反应有:
①Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O;
2CuO+CO2↑+H2O;
②2CuO+C![]() 2Cu+CO2↑;
2Cu+CO2↑;
③CuO+CO![]() Cu+CO2;
Cu+CO2;
④CO2+C![]() 2CO。
2CO。
(1)从四种基本反应类型来看,①②④的反应类型分别为①___________,②___________,④___________。
(2)反应③中,____________发生氧化反应,__________发生还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)==X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25 g·L-1,则:
①反应前O2的体积V(O2)为________。
②X2的摩尔质量为________________。
③Y元素的名称是________________。
(2)取1.43 g Na2CO3·xH2O溶于水配成50mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,共消耗盐酸20.0mL,并收集到112mLCO2(标准状况下)。
①稀盐酸物质的量浓度为________________mol·L-1
②Na2CO3·xH2O的摩尔质量为__________ g·mol-1
③x=________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为______molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配480mL物质的量浓度为0.200molL-1的稀盐酸。
①配制稀盐酸时,应选用容量瓶的规格是_______mL。
②该学生需要用取___mL上述浓盐酸进行配制。
③若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)
量取浓盐酸时俯视刻度线_____,定容时仰视刻度线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物
B. 稀豆浆、硅酸、氯化铁溶液均为胶体
C. 硫酸、盐酸、氢氟酸均为强酸
D. 氯水、水玻璃、氨水均为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有Na+、Fe3+、Mg2+、HCO3-、Cl-、SO42-、SO32-中的若干种,所含离子的物质的量浓度均相同,为了确定该溶液的组成,某同学取100mL上述溶液X,进行如下实验:
![]()
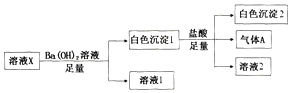
下列说法正确的是
A. 气体A可能是CO2或SO2
B. 溶液X中一定存在Na+、Mg2+、HCO3-、SO42-
C. 溶液X中一定不存在Fe3+和Mg2+,可能存在-Na+
D. 分别在溶液1和溶液2中加入硝酸酸化的硝酸银溶液都能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列有机物的系统命名不正确的是:
A. CH2=CHCH2CH3 1—丁烯
B. C(CH3)4 2,2—二甲基丙烷
C. CH3C≡CCH2CH3 2—戊炔
D. ![]() 对二甲苯
对二甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用碳酸钠晶体配制1.00mol/L的Na2CO3溶液100mL,造成所配溶液浓度偏高的原因是( )
A. 烧杯和玻璃棒没有洗涤
B. 向容量瓶转移液体时,容量瓶事先用蒸馏水洗涤
C. 定容时俯视刻度线
D. 称量碳酸钠晶体(Na2CO310H2O)的烧杯未干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com