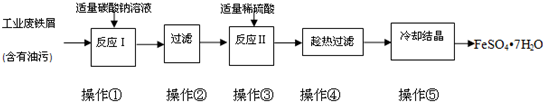
解:(1)操作①中碳酸钠溶液能除去油污,溶液中碳酸根离子水溶液中水解显碱性;反应的离子方程式为:CO
32-+H
2O?HCO
3-+OH
-、HCO
3-+H
2O?H
2CO
3+OH
-;
故答案为:CO
32-+H
2O?HCO
3-+OH
-、HCO
3-+H
2O?H
2CO
3+OH
-;
(2)物质分离方法的原理与过滤相同的是利用滤纸把固体不溶物和溶液分离;依据透性分析判断;
a.蒸馏是分离沸点不同的混合物,故a不符合;
b.分液是利用互不相溶的液体静置分液,故b不符合;
c.渗析是利用半透膜分离溶液和胶体,和过滤原理相同,故c符合;
d.重结晶是利用蒸发浓缩,结晶析出,故d不符合;
故答案为:c;
(3)①配制100mL 1.00×10
-2mol?L
-1的KMnO
4溶液,所用的仪器有天平、烧杯、胶头滴管、100mL容量瓶 玻璃棒;
a、容量瓶不能用来溶解物质,故a错误;
b、容量瓶是准确量配制溶液的量具,最后加水定容,容量瓶洗涤后不需干燥即可直接用于实验;故b正确;
c、定容后摇匀后不需要再加水,加水后溶液浓度减小,故c错误;
d、加水超出刻度,配制失败需要重新配制,故d正确;
故答案为:100mL容量瓶、玻璃棒;bd;
②KMnO
4溶液具有强氧化性,不能盛放在碱式滴定管,因为高锰酸钾溶液腐蚀橡胶管,所以盛放在酸式滴定管中;
故答案为:酸式;KMnO
4溶液有强氧化性能腐蚀橡胶管;
③滴定结束时,消耗浓度为1.00×10
-2mol?L
-1的标准KMnO
4溶液26.00mL,腐蚀的反应为:设铁元素物质的量为x,
5Fe
2++MnO
4-+8H
+═5Fe
3++Mn
2++4H
2O.
5 1
x 1.00×10
-2mol?L
-1×0.0260L
x=1.3×10
-3mol;
铁元素质量=1.3×10
-3mol×56g/mol=0.0728g
2.0g克该补血剂中铁元素含量=
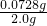
×100%=3.64%
故答案为:3.64.
分析:(1)碳酸钠溶液能除去油污是因为碳酸根离子水溶液中水解显碱性;
(2)过滤是利用滤纸把固体不溶物和溶液分离;依据透性分析判断;
(3)①依据配制溶液的过程和步骤选择仪器;依据溶液配制的实验过程判断;
a、容量瓶不能用来溶解物质;
b、容量瓶是准确量配制溶液的量具,最后加水定容;
c、定容后摇匀后不需要再加水,加水后溶液浓度减小;
d、加水超出刻度,配制失败需要重新配制;
②KMnO
4溶液具有强氧化性,不能盛放在简式滴定管,需要选择酸式滴定管;
③依据氧化还原反应的离子方程式计算得到.
点评:本题考查了盐类水解的应用,物质实验是制备方法和物质性质的分析判断,溶液配制的步骤和仪器选择,滴定实验的计算应用,题目难度中等.

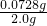 ×100%=3.64%
×100%=3.64%

 天天向上口算本系列答案
天天向上口算本系列答案

