
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

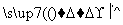

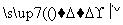

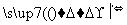

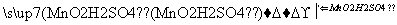

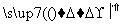

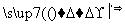

请填写下列空白:
(1)步骤⑤所用的主要仪器是________。
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是____________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是____________________ ___________________________________________________________________________。
(5)①~⑥操作中,使用玻璃棒的是________(填序号)。
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:________________________________________________________________________
________________________________________________________________________。
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
1 LAl2(SO4)3溶液中含有Al3+216 g,取250 mL溶液稀释到4L,则稀释后溶液中
SO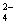 的物质的量浓度是 ( )
的物质的量浓度是 ( )
A.0.25mol/L B.0.5mol/L C.0.75mol/L D.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两位同学根据所学化学知识,设计了由铜和硫酸为原料制取硫酸铜的两种方案:
①铜与浓硫酸直接反应,即Cu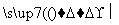 CuSO4
CuSO4
②Cu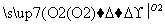 CuO
CuO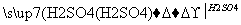 CuSO4
CuSO4
试回答下列问题:
(1)方案①的化学方程式是___________________________________。
(2)这两种方案中,你认为第________种方案较为合理(填序号)。
(3)试从原料用量和环境保护两方面阐述你所选用方案的合理理由是____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
与0.3 mol H2O含有相同氢原子数的物质是( )
A.0.3 mol HNO3
B.3.612×1023个HNO3
C.0.1 mol H3PO4
D.0.2 mol CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的CO和CO2相比较,下列有关叙述中正确的是( )
①它们所含的分子数之比为1∶1 ②它们所含的O原子数目之比为1∶2 ③它们所含的原子总数目之比为2∶3 ④它们所含的C原子数目之比为1∶1 ⑤它们所含的电子数目之比为7∶11
A.①和④ B.②和③
C.④和⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方法能达到目的的是
A.用氨水清洗试管内壁附着的银镜
B.用饱和Na2CO3溶液除去乙醇中少量的乙酸和水
C.制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸
D.可用K3[Fe(CN)6]溶液鉴定FeCl3溶液中是否存在Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
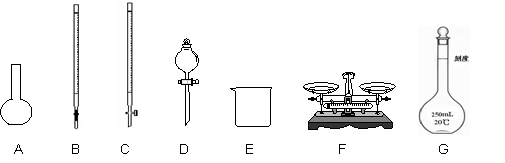
某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E,F和 (填字母)。
(2)步骤②中加入盐酸的作用____________________________ ______。
(3)写出步骤④中发生反应的离子方程式 。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3— + = __Fe3+ + ___Cl— + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响).
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热,冷却至室温,称量其质量为m1g.
(6)本实验若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2 + 6NaOH  5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
则Fe3+、KClO3、Cl2三种物质其氧化性在酸性溶液由强到弱的顺序是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com