
| A、乙烯和苯的分子结构均含有碳碳双键 |
B、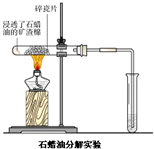 如图石蜡油分解产生的气体只有乙烯,能使溴的CCl4溶液褪色 |
| C、乙烯的产量可以用来衡量一个国家的石油化工生产水平 |
| D、工业常用乙烯与水发生加成反应生产食用酒精 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.
非血红素铁是食物中的铁存在的形式之一,主要是三价铁与蛋白质和羧酸结合成络合物.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| B、高温或日常用的消毒剂可使禽流感病毒蛋白质变性 |
| C、棉花、羊毛、木材和草类的主要成分都是纤维素 |
| D、误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
| C | 乙醇与重铬酸钾(K2Cr2O7)酸性溶液混合 | 乙醇具有还原性 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,冷却,向其中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
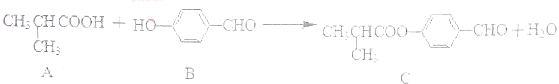
| A、每个A分子中含有1个手性碳原子 |
| B、可以用酸性KMnO4溶液检验B中是否含有醛基 |
| C、1molC分子最多可与4molH2发生加成反应 |
| D、C可发生加成反应、取代反应、氧化反应、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
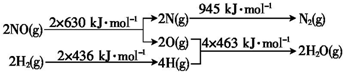 H2还原NO生成氮气和水蒸气的热化学方程式是
H2还原NO生成氮气和水蒸气的热化学方程式是查看答案和解析>>
科目:高中化学 来源: 题型:
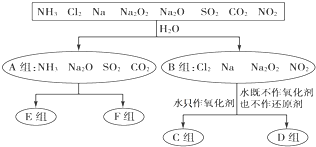
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com