
【题目】综合题。
(1)氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是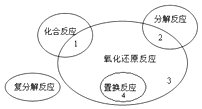
A.Cl2+2KBr═Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3
D.CH4+2O2CO2+2H2O
(2)高锰酸钾和氢溴酸溶液可以发生如下反应:
2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O
①其中还原剂 , 还原产物是 .
②若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为 , 转移电子的物质的量是 .
【答案】
(1)D
(2)HBr;MnBr2;0.5mol;0.5mol
【解析】解:(1)A.Cl2+2KBr═Br2+2KCl属于置换反应,不符合,故A不选;B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑属于分解反应,不符合,故B不选;
Na2CO3+H2O+CO2↑属于分解反应,不符合,故B不选;
C.4Fe(OH)2+O2+2H2O═4Fe(OH)3属于化合反应,不符合,故C不选;
D.CH4+2O2CO2+2H2O不属于化合反应,不属于分解反应,不是置换反应,属于氧化还原反应,符合,故D选;
故选D;(2)①反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高1价,Mn元素化合价降低5价,反应中转移10个电子,反应中KMnO4为氧化剂,MnBr2为还原产物,HBr为还原剂,Br2为氧化产物,所以答案是:HBr;MnBr2;
②若消耗0.1mol氧化剂,则被氧化的还原剂,即发生化合价变化的HBr的物质的量为0.5mol;转移的电子的物质的量为0.5mol,所以答案是:0.5mol;0.5mol.


科目:高中化学 来源: 题型:
【题目】下列热化学方程式书写正确的是(△H的绝对值均正确)( )
A.C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
O2(g)═CO(g)△H=﹣110.5KJmol﹣1(燃烧热)
B.C2H5OH+3O2═2CO2+3H2O△H=﹣1368.8KJmol﹣1(反应热)
C.2NaOH(aq)+H2SO4(aq)═Na2SO4(aq)+2H2O (l)△H=﹣114.6KJmol﹣1(中和热)
D.2H2O(g)═2H2(g)+O2(g)△H=+483.6KJmol﹣1(反应热)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 0.2 mol·L -1某金属阳离子 Rn+的盐溶液 40mL,恰好将 20 mL 0.4 mol·L -1的硫酸盐中的硫酸根离子完全沉淀,则 n 值为( )
A. 1 B. 2 C. 3 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对药物的认识和使用正确的是
A. 感冒时服用适量阿司匹林B. 大部分药物没有副作用
C. 创可贴能用于伤口消炎D. 胃酸过多只要冲服板蓝根冲剂即可治愈
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:

(1)实验室制备Cl2的离子方程式是_____________________________,应选用上图A、E装置中的______(填序号)制Cl2,反应中浓盐酸所表现出的性质是_________________。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是___________________________________。
(3)装置C的作用是____________________________________。
(4)甲乙两名同学分别利用下图所示装置探究两种气体按不同比例混合后的漂白性。试分析:

①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是_____________________。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是(用相应的离子方程式作答)____________
③乙同学在实验过程中发现:通气一段时间后,品红溶液颜色随时间推移变得越来越浅,原因是_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三组溶液:①大豆油和氯化钠溶液 ②39%的乙醇溶液 ③硫酸钠和单质溴的水溶 液,分离以上各混合液的正确方法依次是 ( )
A. 分液、萃取、蒸馏 B. 分液、蒸馏、萃取
C. 萃取、蒸馏、分液 D. 蒸馏、萃取、分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com