
分析 (1)液氨与氢氧化铯反应生成N4分子CsNH2和氢气、水;
(2)加酸时:Na2HPO4与氢离子反应生成NaH2PO4;
加碱时:NaH2PO4与氢氧根离子反应生成Na2HPO4.
解答 解:(1)液氨与氢氧化铯反应生成N4分子CsNH2和氢气、水,则液氨与氢氧化铯反应的化学方程式:8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O;
故答案为:8NH3+4CsOH=N4+4CsNH2+6H2↑+4H2O;
(2)加酸时:Na2HPO4与氢离子反应生成NaH2PO4,其反应的离子方式为:HPO42-+H+=H2PO4-;
加碱时:NaH2PO4与氢氧根离子反应生成Na2HPO4,其反应的离子方程式为:H2PO4-+OH-=HPO42-+H2O;
故答案为:HPO42-+H+=H2PO4-;H2PO4-+OH-=HPO42-+H2O.
点评 本题以弱电解质的电离为载体考查了缓冲溶液,只要溶液中存在弱电解质的电离及其相应离子的水解平衡就能形成缓冲溶液,明确缓冲溶液的缓冲作用,知道混合溶液中存在哪些电离平衡、水解平衡,题目难度不大.


科目:高中化学 来源: 题型:选择题
 常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )
常温下,在某200ml的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(设硝酸只被还原为NO气体).下列有关分析错误的是( )| A. | 原混合酸中NO3-的物质的量为0.2mol | |
| B. | 原混合酸中H2SO4物质的量浓度为2mol•L-1 | |
| C. | OA段与BC段反应中电子转移的物质的量之比为2:1 | |
| D. | 取20ml原混合酸加水稀释至1L后溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

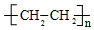 ;
;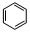 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$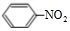 +H2O.
+H2O. ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 电解CuCl2溶液,若阳极生成11.2L的气体,反应中转移电子为1 mol | |
| D. | 将表面有铜绿的铜器放入盐酸中浸泡,除去铜绿 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
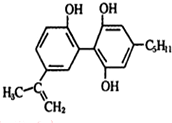 ,有关该物质的说法正确的是( )
,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 滴入KMnO4酸性溶液,观察到紫色褪去,可证明分子中存在双键 | |
| C. | 1mol该物质与足量的碳酸氢钠反应,产生3molCO2 | |
| D. | 1 mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4 mol、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有害垃圾 | B. | 不可回收垃圾 | C. | 可回收垃圾 | D. | 可堆肥垃圾 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com