
【题目】中美科学家在银表面首次获得了二维结构的硼烯,该科研成果发表在顶级刊物《Science》上,并获重点推荐,二维结构的硼烯如图所示。下列说法中错误的是( )
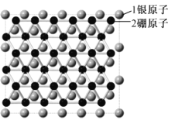
A.1.5mol硼原子核外电子数目为7.5NA
B.1个硼原子与其他原子最多只能形成3对共用电子对
C.硼的氧化物的水化物与NaOH溶液反应可生成BO2-
D.硼烯有望代替石墨烯作“硼烯-钠基”电池的负极材料
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子关系正确的是( )
A.相同温度下,0.2 mol·L-1的醋酸溶液与0.l mol·L-1的醋酸溶液中c(H+)之比大于2 : 1
B.pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
C.0.l mol﹒L-1NaHSO4溶液中:c(H+)=c(SO![]() ) +c(OH-)
) +c(OH-)
D.pH=4、浓度均为0.l mol·L-1的CH3COOH、CH3COONa 混合溶液中:c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在化肥生产、储氢及环境治理等领域发挥着重要作用。
(1)中科院固体研究所的赵惠军和张海民研究团队以MoS2为催化剂,通过调节催化剂/电解质的表界面相互作用,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图1。将Na2SO4溶液换成Li2SO4溶液后,反应速率明显加快的主要原因是加快了下列__转化的反应速率(填标号)。
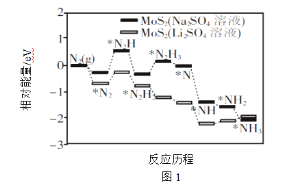
A.N2→*N2 B.*N2→*N2H C.*N2H3→*N D.*NH→*NH2
(2)2017年Dr.KatsutoshiNagaoka等带领的研究团队开发了一种可以“快速启动的氨制氢工艺”。
已知:NH3(g)=![]() H2(g)+
H2(g)+![]() N2(g) ΔH1=+45.9kJ·mol-1
N2(g) ΔH1=+45.9kJ·mol-1
NH3(g)+![]() O2(g)=
O2(g)=![]() H2O(g)+
H2O(g)+![]() N2(g) ΔH2=-318kJ·mol-1
N2(g) ΔH2=-318kJ·mol-1
则快速制氢反应NH3(g)+![]() O2(g)=H2(g)+
O2(g)=H2(g)+![]() H2O(g)+
H2O(g)+![]() N2(g)的ΔH=___kJ·mol-1。
N2(g)的ΔH=___kJ·mol-1。
(3)氨在高温下分解可以产生氢气和氮气。1100℃时,在钨丝表面NH3分解的半衰期(浓度减小一半所需时间)如下表所示:

表中的t5的值为___。c(NH3)的值从2.28×10-3变化至1.14×10-3的过程中,平均反应速率v(H2)=___ mol·L-1·s-1(保留三位有效数字)。
(4)氨催化氧化时会发生两个竞争反应:
Ⅰ:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1
Ⅱ:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1
为分析某催化剂对反应的选择性,在1L密闭容器中存入1mol氨气和2mol的氧气,测得有关物质的物质的量随温度变化的关系如图2。
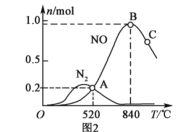
①该催化剂在低温时,选择反应___(填“Ⅰ”或“Ⅱ”)。
②520℃时,4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
4NO(g)+6H2O(g)的平衡常数K=___(只需列出数字计算式,无需计算结果)。
(5)华南理工大学提出利用电解法制H2O2并用产生的H2O2处理废氨水,装置如图3所示。

①IrRu惰性电极有吸附O2的作用,该电极上的反应为__。
②理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
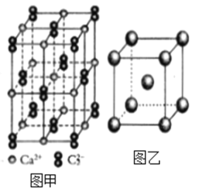
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1D.c(Y2)=0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型的锂离子电池的电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
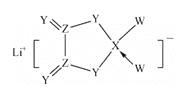
A.W的非金属性比Y的强 B.在该物质中Ⅹ原子满足8电子稳定结构
C.该物质中含离子键和共价键 D.Z的氧化物都易溶于水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电化学法还原CO2是一种使CO2资源化的方法。下图是利用此法制备ZnC2O4的示意图(电解液不参与反应)。下列说法中正确的是

A. Zn与电源的负极相连
B. ZnC2O4在交换膜右侧生成
C. 电解的总反应为2CO2+Zn![]() ZnC2O4
ZnC2O4
D. 通入11.2 L CO2时,转移0.5 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中正确的是( )
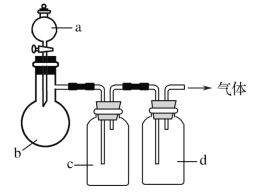
选项 | A | B | C | D |
气体 | CO2 | Cl2 | NH3 | NO |
a | 盐酸 | 浓盐酸 | 饱和NH4Cl溶液 | 稀硝酸 |
b | CaCO3 | MnO2 | 消石灰 | 铜屑 |
c | 饱和Na2CO3溶液 | NaOH溶液 | H2O | H2O |
d | 浓硫酸 | 浓硫酸 | 固体NaOH | 浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
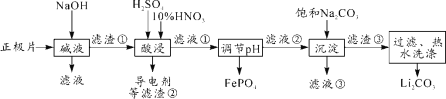
(1)从“正极”可以回收的金属有___________。
(2)“碱溶”时Al箔溶解的离子方程式_________。
(3)“酸浸”时产生标准状况下2.24L NO时,则被氧化的LiFePO4为______mol。(其他杂质不与HNO3反应)
(4)实验测得滤液②中c(Li+)=4 mol·L-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则滤液③中c(CO32-)=________ mol·L-1。 [Ksp(Li2CO3)=1.6×10-3]
(5)磷酸亚铁锂电池总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
Li1-xFePO4+LixC6,电池中的固体电解质可传导Li+。充电时,Li+移向_______(填“阳极”或“阴极”);放电时,正极反应式为_______。
(6)磷酸亚铁锂电池中铁的含量可通过如下方法测定:称取1.40g试样用盐酸溶解,在溶液中加入稍过量的SnCl2溶液,再加入HgCl2饱和溶液,用二苯胺磺酸钠作指示剂,用0.030 mol·L-1重铬酸钾溶液滴定至溶液由浅绿色变为蓝紫色,消耗重铬酸钾溶液40.00mL。
已知:2Fe3++Sn2++6Cl-=SnCl62-+2Fe2+
4Cl-+Sn2++2HgCl2=SnCl62-+Hg2Cl2
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
① 实验中加入HgCl2饱和溶液的目的是__________。
② 磷酸亚铁锂电池中铁的含量为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com