
【题目】三氯化氮(NCl3)常温下是一种淡黄色液体,其分子结构呈三角锥形,以下关于NCl3说法中正确的是( )
A. 分子中N—Cl键是非极性键 B. 分子中不存在孤对电子
C. 它的沸点比PCl3沸点低 D. 因N—Cl键键能大,所以NCl3的沸点高
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
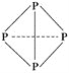
【题目】白磷分子中P—P键易断开,若一个白磷分子中每个P—P键均断开插入一个氧原子,则一共可结合________个氧原子,这样得到磷的一种氧化物,其分子式为________。由C、H、N三种元素组成的某化合物,其分子内含4个氮原子,且4个氮原子排成内空的正四面体(同白磷),每两个氮原子间都有一个碳原子,且分子内无C—C和C===C,则化合物的分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含0.02 molCO2和0.01molCO的混合气体通入有足量Na2O2 固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加_________g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1,键能Eo=o为499.0kJ·mol-1。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=_________kJ·mol-1。
CO2(g)+O(g)的△H=_________kJ·mol-1。
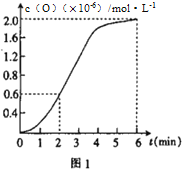
②已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=_________。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1 所示,则0~2 min 内,CO2 的平均反应速率 υ(CO2)=_________。
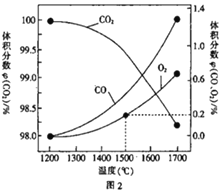
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
2CO(g)+O2(g),1molCO2 在不同温度下的平衡分解量如图2 所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有_________ (填字母)。
A.CO 的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO 的浓度等于生成CO2 的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数 K=_________(计算结果保留1 位小数)。
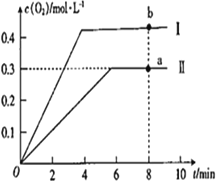
③向恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
2CO(g) +O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II 所示。图中曲线I 是相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是_________;a、 b两点用CO浓度变化表示的净反应速率关系为υa(CO)_________(填“>”“<”或“=”) υb( CO)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学习了氯气的相关知识之后,某化学兴趣小组用下图所示仪器及试剂,进行了实验室制取氯气实验,并探究其相关化学性质。
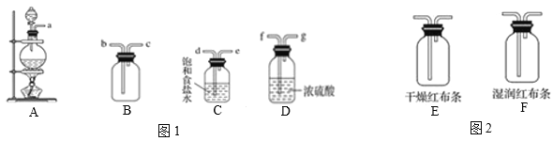
(1)若A中药品为MnO2和浓盐酸,请写出实验原理_____________________(用化学方程式表示)。
(2)将图1各仪器按先后顺序连接起来___________(用导管口处的字母表示)。
(3)C装置的作用_____________________。
(4)验满的方法为_____________________。
(5)把Cl2分别通入图2装置E和F,可以观察到什么现象______________________________;实验目的:_____________________。
(6)实验室除了可以用MnO2和浓盐酸制取Cl2,还可以用哪些药品与浓盐酸反应制取_______________________(用化学方程式表示其反应原理)
(7)该实验有哪些不足之处_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酒后驾车是马路上的第一大杀手。已知酒精(C2H5OH)能与K2Cr2O7和H2SO4的混合溶液在一定条件下发生如下反应:2K2Cr2O7+3C2H5OH+8H2SO4 2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,且知Cr2O72-和Cr3+在溶液中分别显橙色和绿色,回答下列问题:
(1)该反应________(填“是”或“不是”)离子反应。
(2)写出Cr2(SO4)3的电离方程式:______________________________________。
(3)该反应________(填“是”或“不是”)氧化还原反应,判断的依据是_________________________________。
(4)你认为能否用这一反应来检测司机是否酒后驾车?________(填“能”或“不能” ),简述其原理________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常用酸性高锰酸钾溶液和草酸溶液的反应用于测定血钙的含量回答下列问题:
(1)配平以下离子方程式,并用单线桥表示电子转移的方向和数目:
______+_____MnO4-+_____H2C2O4=_____CO2↑+_____Mn2++____。
(2)该反应中的还原剂是______。
(3)反应转移了0.4mol电子,则消耗KMnO4的物质的量为______mol。
(4)将一定质量的镁、铝合金投入100 mL一定物质的量浓度的HCl中,合金全部溶解,向所得溶液中滴加5 mol·L-1NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如下图。
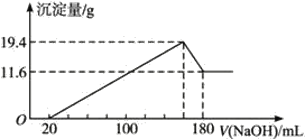
①原合金中铝的质量分数是___________。
②盐酸的物质的量浓度是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用VSEPR推断分子或离子的空间构型。
PO![]() __________;CS2____________;AlBr3(共价分子)__________。
__________;CS2____________;AlBr3(共价分子)__________。
(2)有两种活性反应中间体粒子,它们的粒子中均含有1个碳原子和3个氢原子。请依据下面给出的这两种粒子的球棍模型,写出相应的化学式:
 ______;
______;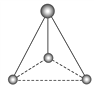 ______。
______。
(3)按要求写出第二周期非金属元素构成的中性分子的化学式。
平面三角形分子________,三角锥形分子________,四面体形分子________。
(4)为了解释和预测分子的空间构型,科学家在归纳了许多已知的分子空间构型的基础上,提出了一种十分简单的理论模型——价层电子对互斥模型。这种模型把分子分成两类:一类是____________________;另一类是____________________。BF3和NF3都是四个原子的分子,BF3的中心原子是________,NF3的中心原子是________;BF3分子的立体构型是平面三角形而NF3分子的立体构型是三角锥形的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,国际上提出的“绿色化学”是指化学工业生产中( )。
A.对废水、废气、废渣进行严格处理
B.化学生产中不排放任何有害物质
C.化工厂及周围种草、种树、种花,使工厂成为花园式工厂
D.以绿色植物为原料,以生物催化剂实现化工生产过程的化学
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com