
°ĺŐ‚ńŅ°Ņ[ĽĮ—ß“Ľ—°–ř3£ļőÔ÷ ĹŠĻĻ”Ž–‘÷ ]
ľōļÕĶ‚ĶńŌŗĻōĽĮļŌőÔ‘ŕĽĮĻ§°Ę“Ĺ“©°Ę≤ńŃŌĶ»Ńž”Ú”–◊ŇĻ„∑ļĶń”¶”√°£ĽōīūŌ¬Ń–ő Ő‚£ļ
(1)‘™ňōKĶń—ś…ę∑ī”¶≥ ◊Ōļž…ę£¨∆š÷–◊Ō…ę∂‘ŃĘĶń∑Ý…š≤®≥§ő™_____________nm(ŐÓ–ÚļŇ)°£
A.589.2 B.500.3 C.650.2 D.434.4
(2)KļÕFe Ű”ŕÕ¨“Ľ÷‹∆ŕ£¨«“ļňÕ‚◊ÓÕ‚≤„ĶÁ◊”ĻĻ–ÕŌŗÕ¨£¨ĶęĹū ŰKĶń»ŘĶ„°Ę∑–Ķ„Ķ»∂ľĪ»Ĺū ŰFeĶÕ£¨‘≠“Ú «________________________°£
(3)ĽýŐ¨I‘≠◊”÷–£¨ļňÕ‚ĶÁ◊”’ľĺ›◊ÓłŖń‹≤„Ķń∑ŻļŇő™_____________________°£
(4)KIO3ĺßŐŚ «“Ľ÷÷–‘ń‹Ńľļ√Ķń∑«ŌŖ–‘Ļ‚—ß≤ńŃŌ£¨ĺŖ”–ł∆Ó—Ņů–ÕĶńŃĘ∑ĹĹŠĻĻ£¨ĪŖ≥§a=0.446am£¨ĺßįŻ÷–K°ĘI°ĘO∑÷Īūī¶”ŕ∂•Ĺ«°ĘŐŚ–ń°Ę√ś–ńőĽ÷√£¨»ÁÕľňý ĺ£¨K”ŽOľšĶń◊Ó∂ŐĺŗņŽő™________nm£¨”ŽKĹŰŃŕĶńOłŲ żő™_____________________°£
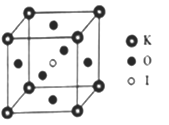
(5)‘ŕKIO3ĺßįŻĹŠĻĻĶńŃŪ“Ľ÷÷ĪŪ ĺ÷–£¨Iī¶”ŕłų∂•Ĺ«őĽ÷√£¨‘ÚKī¶”ŕ________őĽ÷√£¨Oī¶”ŕ__________őĽ÷√°£
°ĺīūįł°Ņ D KĶń÷ ◊” żĹŌ…Ŕ£¨įŽĺ∂ĹŌīů£¨‘≠◊”ļň∂‘◊ÓÕ‚≤„ĶÁ◊”Ķń ÝłŅ◊ų”√ĹŌFełŁ»ű£¨–ő≥…ĶńĹū ŰľŁĹŌ»ű£¨Ķľ÷¬»Ř∑–Ķ„ĹŌĶÕ O ![]() 12 ŐŚ–ń ņ‚–ń
12 ŐŚ–ń ņ‚–ń
°ĺĹ‚őŲ°Ņ£®1£©◊Ō…ęĻ‚Ķń≤®≥§ő™400°ę435nm£¨ňý“‘—°ŌÓD’ż»∑°£
£®2£©KĶń‘≠◊”įŽĺ∂īů”ŕŐķ£¨«“ľŘĶÁ◊” żĹŌ…Ŕ£¨ňý“‘Ĺū ŰľŁĹŌ»ű£¨»Ř∑–Ķ„ĹŌĶÕ°£
£®3£©IőĽ”ŕĶŕňń÷‹∆ŕĶŕ∆Ŗ÷ų◊Ś£¨ňý“‘ĶÁ◊”Ķń◊ÓłŖń‹≤„ő™ĶŕňńĶÁ◊”≤„£¨ľīN≤„°£
£®4£©łýĺ›ĺßįŻĹŠĻĻĶ√ĶĹKļÕO÷ģľšĶń◊Ó∂ŐĺŗņŽő™√ś∂‘Ĺ«ŌŖĶń“ĽįŽ£¨ňý“‘ «![]() °£łýĺ›ĺßįŻĹŠĻĻĶ√ĶĹ√ŅłŲKĹŰŃŕĶńOő™√ŅłŲ∂•Ķ„ŌŗѨĶń12łŲ√śĶń√ś–ń£¨ňý“‘ «12łŲ°£
°£łýĺ›ĺßįŻĹŠĻĻĶ√ĶĹ√ŅłŲKĹŰŃŕĶńOő™√ŅłŲ∂•Ķ„ŌŗѨĶń12łŲ√śĶń√ś–ń£¨ňý“‘ «12łŲ°£
£®5£©“Úő™KļÕI «ŌŗĶ»Ķń£¨ňý“‘IőĽ”ŕ∂•Ķ„ Ī”¶ł√”–8°Ń![]() łŲ£¨Kő™ŃňĪ£÷§ «“ĽłŲ£¨÷Ľń‹őĽ”ŕŐŚ–ń£¨īň ĪŇ–∂Ō≥ŲO‘ŕņ‚–ń°£
łŲ£¨Kő™ŃňĪ£÷§ «“ĽłŲ£¨÷Ľń‹őĽ”ŕŐŚ–ń£¨īň ĪŇ–∂Ō≥ŲO‘ŕņ‚–ń°£


 √Ż–£ŅőŐ√ŌĶŃ–īūįł
√Ż–£ŅőŐ√ŌĶŃ–īūįł
| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬ĪŪő™‘™ňō÷‹∆ŕĪŪĶń“Ľ≤Ņ∑÷°£

£®1£©Ęř‘ŕ‘™ňō÷‹∆ŕĪŪ÷–ĶńőĽ÷√ «___________________________°£
£®2£©‘ŕ…ŌĪŪ‘™ňō÷–£¨∑«Ĺū Ű–‘◊Ó«ŅĶń «________£®ŐÓ‘™ňō∑ŻļŇ£©°£
£®3£©Ī»ĹŌĘŔ°ĘĘ›Ķń‘≠◊”įŽĺ∂ļÕ∆ÝŐ¨«‚ĽĮőÔĶńő»∂®–‘£ļ‘≠◊”įŽĺ∂–°Ķń «________£®ŐÓ‘™ňō∑ŻļŇ£©£¨∆ÝŐ¨«‚ĽĮőÔłŁő»∂®Ķń «______________£®ŐÓĽĮ—ß Ĺ£©°£
£®4£©ĘŘĶń◊ÓłŖľŘ—űĽĮőÔ∂‘”¶ĶńňģĽĮőÔ”ŽĘ‹Ķń—űĽĮőÔ∑ī”¶ĶńņŽ◊”∑Ĺ≥Ő Ĺ «£ļ
_____________________________________________________________________°£
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬√śĻō”ŕĶÁĹ‚÷ ĶÁņŽĶń–ū Ų’ż»∑Ķń «£® £©
A.CaCO3‘ŕňģ÷–»‹Ĺ‚∂»ļ‹–°£¨∆šĶľĶÁń‹Ń¶ļ‹»ű£¨ňý“‘ CaCO3 «»űĶÁĹ‚÷
B.CaCO3‘ŕňģ÷–»‹Ĺ‚∂»ļ‹–°£¨Ķ껋łĶń CaCO3»ę≤ŅĶÁņŽ£¨ňý“‘ CaCO3 ««ŅĶÁĹ‚÷
C.¬»∆ÝļÕįĪ∆ÝĶńňģ»‹“ļĶľĶÁ–‘∂ľļ‹ļ√£¨ňý“‘ňŁ√« ««ŅĶÁĹ‚÷
D.ňģń—ĶÁņŽ£¨īŅňģľłļű≤ĽĶľĶÁ£¨ňģ «∑«ĶÁĹ‚÷
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņń≥ő¬∂»Ō¬£¨ŌÚ2Lļ„»›√‹Ī’»›∆ų÷–≥š»Ž1.0mol AļÕ1.0mol B£¨∑ī”¶A£®g£©+B£®g£©C£®g£©ĺ≠Ļż“Ľ∂ő ĪľšļůīÔĶĹ∆Ĺļ‚£ģ∑ī”¶Ļż≥Ő÷–≤‚∂®Ķń≤Ņ∑÷ żĺ›ľŻŌ¬ĪŪ£¨Ō¬Ń–ňĶ∑®’ż»∑Ķń «£® £©
t/s | 0 | 5 | 15 | 25 | 35 |
n£®A£©/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.∑ī”¶‘ŕ«į5sĶń∆ĹĺýňŔ¬ v£®A£©=0.17molL©Ā1s©Ā1
B.Ī£≥÷∆šňŻŐűľĢ≤ĽĪš£¨…żłŖő¬∂»£¨∆Ĺļ‚ Īc£®A£©=0.41molL©Ā1 £¨ ‘Ú∑ī”¶Ķń°ųH£ĺ0
C.ŌŗÕ¨ő¬∂»Ō¬£¨∆ū ľ ĪŌÚ»›∆ų÷–≥š»Ž2.0mol C£¨īÔĶĹ∆Ĺļ‚ Ī£¨CĶń◊™ĽĮ¬ īů”ŕ80%
D.ŌŗÕ¨ő¬∂»Ō¬£¨∆ū ľ ĪŌÚ»›∆ų÷–≥š»Ž0.20mol A£¨0.20mol BļÕ1.0mol C£¨∑ī”¶īÔĶĹ∆Ĺļ‚«įv£®’ż£©£ľv£®ńś£©
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–őÔ÷ ÷–£¨ Ű”ŕĶÁĹ‚÷ Ķń «£®°°°°£©
A.«‚—űĽĮń∆»‹“ļ
B.¬»ĽĮń∆
C.Ĺū ŰÕ≠
D.’ŠŐ«
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ‘ŕCl2+S2-=2Cl-+S°żĶńņŽ◊”∑ī”¶÷–£¨S2-īķĪŪĶńőÔ÷ Ņ…“‘ «£® £©
A.H2SB.KHSC.FeSD.Na2S
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–őÔ÷ Ű”ŕĻ≤ľŘĽĮļŌőÔĶń «£®°°°°£©
A.NH4Cl
B.MgO
C.H2O
D.CaCl2
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņő™ŃňŐĹĺŅŐķ°ĘÕ≠ľį∆šĽĮļŌőÔĶń–‘÷ £¨ń≥Õ¨—ß…Ťľ∆≤ĘĹÝ––ŃňŌ¬Ń–ŃĹ◊ť Ķ—ť°£
Ķ—ť“Ľ£ļ
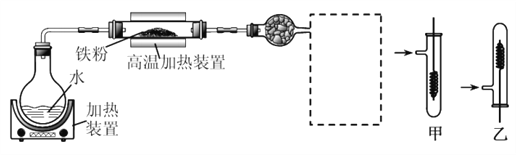
“—÷™£ļ3Fe(s)£ę4H2O(g)![]() Fe3O4(s)£ę4H2(g)
Fe3O4(s)£ę4H2(g)
£®1£©–ťŌŖŅÚī¶“ň—°‘ŮĶń◊į÷√ «________(ŐÓ°įľ◊°ĪĽÚ°į““°Ī)£Ľ Ķ—ť Ī”¶Ō»Ĺ꬛–ż◊īÕ≠ňŅľ”»»£¨Īšļŕļů‘Ŕ≥√»»—łňŔ…ž»Žňý÷∆Ķ√ĶńīŅ弫‚∆Ý÷–£¨ĻŘ≤žĶĹĶń Ķ—ťŌ÷Ōů «______________________°£
£®2£© Ķ—ťļů£¨ő™ľž—ť”≤÷ ≤£ŃßĻ‹÷–ĶńĻŐŐŚ «∑Ůļ¨£ę3ľŘĶńŐķ‘™ňō£¨ł√Õ¨—ß»°“Ľ∂®ŃŅĶńĻŐŐŚ≤Ę”√“Ľ∂®Ň®∂»Ķń—őňŠ»‹Ĺ‚£¨Ķőľ”_______»‹“ļ£®ŐÓ ‘ľŃ√Ż≥∆ĽÚĽĮ—ß Ĺ£©£¨√Ľ”–≥ŲŌ÷—™ļž…ę£¨ňĶ√ųł√ĻŐŐŚ÷–√Ľ”–£ę3ľŘĶńŐķ‘™ňō°£«Žń„Ň–∂Ōł√Õ¨—ßĶńĹŠ¬Ř «∑Ů’ż»∑≤ĘňĶ√ųņŪ”…_________________°£
Ķ—ť∂Ģ£ļ
¬Ő∑Į «ļ¨”–“Ľ∂®ŃŅĹŠĺßňģĶńŃÚňŠ—«Őķ£¨ő™≤‚∂®¬Ő∑Į÷–ĹŠĺßňģļ¨ŃŅ£¨Ĺę Į”Ę≤£ŃßĻ‹£®īÝŃĹ∂ňŅ™ĻōK1ļÕK2£®…Ťő™◊į÷√A£©≥∆÷ō£¨ľ«ő™m1 g°£Ĺę—ý∆∑◊į»Ž Į”Ę≤£ŃßĻ‹÷–£¨‘ŔīőĹę◊į÷√A ≥∆÷ō£¨ľ«ő™m2 g£¨Bő™ł…‘ÔĻ‹°£įīŌ¬ÕľŃ¨Ĺ”ļ√◊į÷√ĹÝ–– Ķ—ť°£
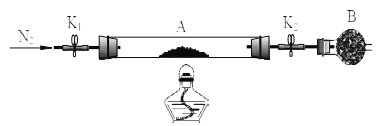
Ķ—ť≤Ĺ÷Ť»ÁŌ¬£ļ£®1£©________£¨£®2£©Ķ„»ľĺ∆ĺęĶ∆£¨ľ”»»£¨£®3£©______£¨£®4£©______£¨£®5£©______£¨
£®6£©≥∆ŃŅA£¨ ÷ōłī…Ō Ų≤Ŕ◊ų≤Ĺ÷Ť£¨÷Ī÷Ń A ļ„÷ō£¨ľ«ő™m3 g°£
£®3£©«ŽĹęŌ¬Ń– Ķ—ť≤Ĺ÷ŤĶńĪŗļŇŐÓ–ī‘ŕ∂‘”¶≤Ĺ÷ŤĶńļŠŌŖ…Ō
a£ģĻōĪ’ K1 ļÕ K2 b£ģŌ®√ūĺ∆ĺęĶ∆ c£ģīÚŅ™ K1 ļÕ K2 ĽļĽļÕ®»Ž N2 d£ģņš»ī÷Ń “ő¬
£®4£©Īō–Ž“™ĹÝ––ļ„÷ō≤Ŕ◊ųĶń‘≠“Ú «_________________°£
£®5£©“—÷™‘ŕ…Ō Ų Ķ—ťŐűľĢŌ¬£¨¬Ő∑Į ‹»»÷Ľ « ß»•ĹŠĺßňģ£¨ŃÚňŠ—«ŐķĪĺ…Ū≤ĽĽŠ∑÷Ĺ‚£¨ łýĺ› Ķ—ťľ«¬ľ£¨
ľ∆ň„¬Ő∑ĮĽĮ—ß Ĺ÷–ĹŠĺßňģ żńŅ x=__________________£®”√ļ¨ m1°Ę m2°Ę m3ĶńŃ– ĹĪŪ ĺ£©°£
°ĺīūįł°Ņ ““ Õ≠ňŅ”…ļŕĪšļž ŃÚ«ŤĽĮľōĽÚ KSCN ≤Ľ’ż»∑£¨“Úő™ŐķĻżŃŅ Ī£ļ Fe£ę2Fe3+°ķ3Fe2+ c b d a »∑Ī£¬Ő∑Į÷–ĶńĹŠĺßňģ“—»ę≤Ņ ß»• ![]()
°ĺĹ‚őŲ°Ņ ‘Ő‚∑÷őŲ£ļ Ķ—ť“Ľ£ļ£®1£©Őķ”Žňģ’Ű∆Ý∑ī”¶…ķ≥…Fe3O4ļÕ«‚∆Ý£¨–ťŌŖŅÚ÷–Ķń◊į÷√ «”√«‚∆ÝĽĻ‘≠—űĽĮÕ≠Ķń◊į÷√£¨łý囫‚∆ÝĶń√‹∂»Ī»Ņ’∆Ý–°∑÷őŲ£Ľ—űĽĮÕ≠ĪĽ«‚∆ÝĽĻ‘≠ő™Õ≠Ķ•÷ £Ľ£®2£©Fe3+ń‹ ĻKSCN»‹“ļĪš≥…—™ļž…ę£ĽĶ•÷ Őķń‹į—Fe3+ĽĻ‘≠ő™Fe2+£Ľ
Ķ—ť∂Ģ£ļ£®3£©”…”ŕ◊į÷√÷–ļ¨”–Ņ’∆Ý£¨Ņ’∆Ýń‹—űĽĮŃÚňŠ—«Őķ£¨ňý“‘ľ”»»«į“™ŇŇĺ°◊į÷√÷–ĶńŅ’∆Ý£¨ņŻ”√Ķ™∆ÝŇŇ≥ŲŅ’∆Ý£¨ő™ Ļ…ķ≥…Ķńňģ’Ű∆ÝÕÍ»ęŇŇ≥Ų£¨”¶ł√Ō»Ō®√ūĺ∆ĺęĶ∆‘ŔĻōĪ’K1 ļÕ K2£Ľņš»īļů‘Ŕ≥∆ŃŅ£Ľ£®4£©ĹÝ––ļ„÷ō≤Ŕ◊ųŅ…“‘»∑Ī£¬Ő∑Į÷–ĶńĹŠĺßňģ“—»ę≤Ņ ß»•£Ľ£®5£©łýĺ›Ő‚“‚£¨…ķ≥…ŃÚňŠ—«Őķ «![]() £¨…ķ≥…ňģĶń÷ ŃŅ «
£¨…ķ≥…ňģĶń÷ ŃŅ «![]() £¨łýĺ›
£¨łýĺ›![]() ľ∆ň„x÷Ķ£Ľ
ľ∆ň„x÷Ķ£Ľ
Ĺ‚őŲ£ļ Ķ—ť“Ľ£ļ£®1£©Őķ”Žňģ’Ű∆Ý∑ī”¶…ķ≥…Fe3O4ļÕ«‚∆Ý£¨–ťŌŖŅÚ÷–Ķń◊į÷√ «”√«‚∆ÝĽĻ‘≠—űĽĮÕ≠Ķń◊į÷√£¨«‚∆ÝĶń√‹∂»Ī»Ņ’∆Ý–°£¨ňý“‘”√ŌÚŌ¬ŇŇŅ’∆Ý∑® ’ľĮ«‚∆Ý£¨Ļ —°““£Ľ—űĽĮÕ≠ĪĽ«‚∆ÝĽĻ‘≠ő™Õ≠Ķ•÷ £¨Ō÷Ōů «Õ≠ňŅ”…ļŕĪšļž£Ľ£®2£©Fe3+ń‹ ĻKSCN»‹“ļĪš≥…—™ļž…ę£¨Ķőľ”KSCN»‹“ļľž—ť «∑Ůļ¨”–Fe3+£¨»Ű»‹“ļĪšő™—™ļž…ę£¨‘Úļ¨”–Fe3+£ĽĶ•÷ Őķń‹į—Fe3+ĽĻ‘≠ő™Fe2+£¨ĶĪŐķĻżŃŅ Ī£ļ Fe£ę2Fe3+=3Fe2+£¨ňý“‘√Ľ”–≥ŲŌ÷—™ļž…ę£¨≤Ľń‹ňĶ√ųł√ĻŐŐŚ÷–√Ľ”–£ę3ľŘĶńŐķ‘™ňō£Ľ
Ķ—ť∂Ģ£ļ£®3£©”…”ŕ◊į÷√÷–ļ¨”–Ņ’∆Ý£¨Ņ’∆Ýń‹—űĽĮŃÚňŠ—«Őķ£¨ňý“‘ľ”»»«į“™ŇŇĺ°◊į÷√÷–ĶńŅ’∆Ý£¨ņŻ”√Ķ™∆ÝŇŇ≥ŲŅ’∆Ý£¨ő™ Ļ…ķ≥…Ķńňģ’Ű∆ÝÕÍ»ęŇŇ≥Ų£¨”¶ł√Ō»Ō®√ūĺ∆ĺęĶ∆‘ŔĻōĪ’K1 ļÕ K2£Ľņš»īļů‘Ŕ≥∆ŃŅ£¨’ż»∑Ķń≤Ĺ÷Ť «£®1£©īÚŅ™ K1 ļÕ K2 ĽļĽļÕ®»Ž N2£¨£®2£©Ķ„»ľĺ∆ĺęĶ∆£¨ľ”»»£¨£®3£©Ō®√ūĺ∆ĺęĶ∆£¨£®4£©ņš»ī÷Ń “ő¬£¨£®5£©ĻōĪ’ K1 ļÕ K2£¨£®6£©≥∆ŃŅA£¨ ÷ōłī…Ō Ų≤Ŕ◊ų≤Ĺ÷Ť£¨÷Ī÷Ń A ļ„÷ō£¨ľ«ő™m3 g£Ľ£®4£©ĹÝ––ļ„÷ō≤Ŕ◊ųŅ…“‘»∑Ī£¬Ő∑Į÷–ĶńĹŠĺßňģ“—»ę≤Ņ ß»•£Ľ£®5łýĺ›Ő‚“‚£¨…ķ≥…ŃÚňŠ—«Őķ «![]() £¨…ķ≥…ňģĶń÷ ŃŅ «
£¨…ķ≥…ňģĶń÷ ŃŅ «![]() £¨
£¨

X=![]() °£
°£
°ĺŐ‚–Õ°Ņ Ķ—ťŐ‚
°ĺĹŠ Ý°Ņ
24
°ĺŐ‚ńŅ°ŅPTT «“Ľ÷÷łŖ∑÷◊”≤ńŃŌ£¨ĺŖ”–”Ň“ž–‘ń‹£¨ń‹◊ųő™Ļ§≥Őň‹ŃŌ°Ę∑ń÷ĮŌňő¨ļÕĶōŐļĶ»≤ńŃŌ∂ÝĶ√ĶĹĻ„∑ļ”¶”√°£∆šļŌ≥…¬∑ŌŖŅ……Ťľ∆ő™£ļ

“—÷™£ļ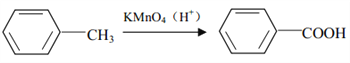
£®1£©B ÷–ňýļ¨ĻŔń‹ÕŇĶń√Ż≥∆ő™_________£¨∑ī”¶ĘŕĶń∑ī”¶ņŗ–Õő™_________°£
£®2£©∑ī”¶ĘŘĶńĽĮ—ß∑Ĺ≥Ő Ĺő™_________°£
£®3£©–ī≥Ų PTT ĶńĹŠĻĻľÚ Ĺ_________°£
£®4£©ń≥”–ĽķőÔX Ķń∑÷◊” Ĺő™C4H6O£¨X”ŽBĽ•ő™Õ¨ŌĶőÔ,–ī≥ŲXŅ…ń‹ĶńĹŠĻĻľÚ Ĺ_________°£
£®5£©«Ž–ī≥Ų“‘ CH2=CH2 ő™÷ų“™‘≠ŃŌ£®őřĽķ ‘ľŃ»ő”√£©÷∆Īł““ňŠ““ű•ĶńļŌ≥…¬∑ŌŖŃų≥ŐÕľ£®–Ž◊Ę√ų∑ī”¶ŐűľĢ£©°££®ļŌ≥…¬∑ŌŖ≥£”√ĶńĪŪ ĺ∑Ĺ Ĺő™£ļ![]() £©____________
£©____________
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅŌ¬Ń–”–ĻōÕťŐĢĶń–ū Ų÷–£¨≤Ľ’ż»∑Ķń «
A. ‘ŕÕťŐĢ∑÷◊”÷–£¨ňý”–ĶńĽĮ—ßľŁ∂ľő™Ķ•ľŁ
B. ňý”–ĶńÕťŐĢ‘ŕĻ‚’’ŐűľĢŌ¬∂ľń‹”Ž¬»∆Ý∑Ę…ķ»°īķ∑ī”¶
C. ÕťŐĢ∑÷◊”ĶńÕ® Ĺő™CnH2n+2£¨∑ŻļŌł√Õ® ĹĶńŐĢ≤Ľ“Ľ∂® «ÕťŐĢ
D. ňś◊ŇŐľ‘≠◊”Ķń‘Ųľ”£¨ÕťŐĢĶń»Ř°Ę∑–Ķ„÷ūĹ•…żłŖ°£
≤ťŅīīūįłļÕĹ‚őŲ>>
įŔ∂»÷¬–Ň - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com