
(9分)有关物质间有下图所示的转化关系。其中:A的浓溶液与单质B在加热时才发生反应①;A的稀溶液与足量B发生反应②。据此填写下列空白: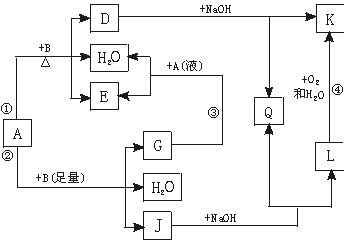
(1)反应④的现象是 。
(2)写出反应②的离子方程式 。
(3)根据题示信息判断,A的浓溶液和单质B加热时能否产生G,说明理由(写出化学方程式回答):
(1)白色沉淀 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?
(2)3Fe+2NO3-+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
解析试题分析:(1)A的浓溶液与单质B在加热时才发生反应①,A的稀溶液与足量B不加热可发生反应②,且②有3种产物,猜测A是硝酸,不是硫酸;硝酸具有强氧化性,与浓硝酸需加热才进行的B应是与浓硝酸发生钝化的金属铁或铝;由反应④可知B是变价金属铁;则J是硝酸亚铁,与氢氧化钠反应生成氢氧化亚铁和硝酸钠;所以反应④是氢氧化亚铁与氧气、水反应生成氢氧化铁的反应,现象是白色沉淀迅速转化为灰绿色,最终成为红褐色;
(2)反应②是稀硝酸与过量Fe反应生成硝酸亚铁、水、NO,离子方程式为3Fe+2NO3-+8H+="3" Fe 2++2NO↑+4 H2O;
(3)由流程图可知G是NO,与硝酸反应又生成NO2和水,所以浓硝酸与铁加热反应时,若生成NO立即又转化为NO2,所以实质是不可能生成NO。
考点:考查物质推断,离子方程式的书写,对题目信息的理解应用


科目:高中化学 来源: 题型:单选题
金属钠是一种活泼金属,除了具有金属的一般性质外,还具有自己的特性。关于钠的叙述中,正确的是
| A.钠是银白色金属,熔点低,硬度大 |
| B.钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠 |
| C.加热时,金属钠剧烈燃烧,产生黄色火焰 |
| D.金属钠着火可以用泡沫灭火器或用干燥的沙土灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某兴趣小组设计如下装置进行氯气与金属钠的反应,先将钠预热,在钠熔融成小球时,撤火,并通入氯气即发生反应,下列叙述中错误的是
| A.钠着火剧烈燃烧产生苍白色的火焰 |
| B.反应产生的大量白烟是氯化钠固体 |
| C.棉球①的作用是吸收过量氯气防止产生污染 |
| D.棉球②变蓝色则证明氯气未被碱液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)用氯化铝溶液与氢氧化钠溶液反应时:
(1)当Al3+的物质的量与OH-的物质的量之比为 时,Al(OH)3沉淀量最多;
(2)当Al3+的物质的量与OH-的物质的量之比 时,Al(OH)3全部溶解;
(3)当Al3+的物质的量与OH-的物质的量之比 或 时,Al(OH)3沉淀量为最多沉淀量的一半。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(2分)冶炼金属的三种常用方法是:①热分解法 ②热还原剂法 ③电解法。人类用量处在前三位的金属是铁、铝、铜。(填编号)
(1)冶炼铝用到的方法是 ;
(2)冶炼铁和铜的常用方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4?5H2O):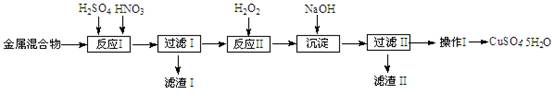
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
 = 2Iˉ+S4O
= 2Iˉ+S4O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)
某些化学反应可用下式表示A+B→→C+D+H2O。请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
(3)若A、C均含有铝元素。①当B是盐酸时,C是 ;
②当B是NaOH时,C是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)下图是研究铜与浓硫酸的反应装置: 
(1)A试管中发生反应的化学方程式为 。
(2)反应一段时间后,可观察到B试管中的现象为 。
(3)C试管口浸有NaOH溶液的棉团作用是 。
(4)实验结束后,证明A试管中反应所得产物是否含有铜离子的操作方法是 。
(5)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
| 资料1 |  附表铜与浓硫酸反应产生黑色物质的相关性质 |
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关FeSO4的转化关系如图所示(部分物质已略去)。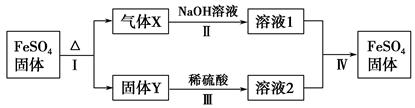
已知:①X由两种化合物组成,将X通入品红溶液,溶液退色;通入BaCl2溶液,产生白色沉淀。
②Y是红棕色的化合物。
(1)气体X的成分是(填化学式) 。
(2)反应Ⅰ的反应类型属于(填序号) 。
a.分解反应
B.复分解反应
c.置换反应
D.化合反应
e.氧化还原反应
(3)溶液2中金属阳离子的检验方法是 。
(4)若经反应Ⅰ得到16 g固体Y,产生的气体X恰好被0.4 L 1 mol·L-1 NaOH溶液完全吸收,则反应Ⅳ中生成FeSO4的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com