
Fe(OH)2是铁的一种氢氧化物,难溶于水,具有还原性,其制备方法较为特殊。下面是实验室制备
Fe(OH)2的方法之一:
(1)制备原理:利用复分解反应,使可溶性的亚铁盐溶液与可溶性的碱液反应生成Fe(OH)2。写出该反应的离子方程式_________________。
(2)NaOH溶液的制备:在试管中加入2~3 mL蒸馏水,加热至沸腾,冷却至室温,加入1片NaOH固体。制备NaOH溶液的蒸馏水加热的目的是___________。
(3)FeSO4溶液的制备:在试管中加入5 mL蒸馏水,并加热,直至蒸馏水沸腾,然后向蒸馏水中滴入几滴稀硫酸;待蒸馏水冷却至室温,加入少量FeSO4晶体,为了防止溶液中的Fe2+被氧化,在溶液中加入少量
____________。加入FeSO4晶体前在蒸馏水中加入稀硫酸的目的是____________。
(4) Fe(OH)2的制备:下图中的胶头滴管中盛有NaOH溶液,试管中是FeSO4溶液。制备Fe(OH)2时正确的操作是___________(填字母序号),操作过程中________(填“能”或“不能”)振荡试管,原因是___________________。
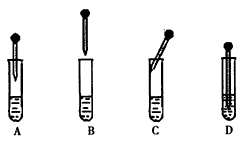
科目:高中化学 来源: 题型:
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江“五校联谊”高一上学期期末考试化学卷 题型:实验题
(12分) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为: 。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液 与用不含O2的蒸馏水配制的NaOH溶液反应制备。
与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入 。(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4 溶液液面下,再挤出NaOH溶液,这样操作的理由是 。
(4)检验Fe3+存在的最佳试剂是 ,现象是 。
(5)写出Fe与H20在一定条件下反应的化学方程式  。
。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省宁德市毕业班质量检查(理综)化学部分 题型:填空题
硫铁矿烧渣是硫铁矿生产硫酸过程中产生的工业废渣(主要含Fe2O3及少量SiO2、Al2O3、CaO、MgO等杂质)。用该烧渣制取药用辅料——红氧化铁的工艺流程如下:
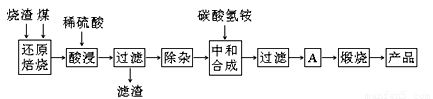
(1)在“还原焙烧”中产生的有毒气体可能有 。
(2)“酸浸”时间一般不超过20 min,若在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因用离子方程式表示: 。
(3)根据下表数据:
|
氢氧化物 |
Al(OH)3 |
Mg(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
开始沉淀的pH |
3.10 |
8.54 |
2.01 |
7.11 |
|
完全沉淀的pH |
4.77 |
11.04 |
3.68 |
9.61 |
在“除杂”步骤中,为除去Fe3+和Al3+,溶液的pH最大值应小于 ,当pH=5时,溶液中c(Al3+)为 mol·L-1(已知常温下Ksp[Al(OH)3]=2.0×10-33)。
(4)“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,碳酸氢铵与硫酸亚铁反应的离子方程式为 。
若用等物质的量的碳酸铵替代碳酸氢铵,则产品中可能混有的杂质是 。
(5)A的操作是 。
(6)m g烧渣经过上述工艺可得红氧化铁n g。药典标准规定,制得的红氧化铁中含氧化铁不得少于98.0%,则所选用的烧渣中铁的质量分数应不低于 (用含m、n的表达式表示)。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江“五校联谊”高一上学期期末考试化学卷 题型:实验题
(12分) Fe(OH)2很不稳定,露置在空气中容易被氧化,Fe(OH)2被氧化的化学方程为: 。为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时你觉得还需加入 。(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4 溶液液面下,再挤出NaOH溶液,这样操作的理由是 。
(4)检验Fe3+存在的最佳试剂是 ,现象是 。
(5)写出Fe与H20在一定条件下反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com